定義
「ポリヌクレオチド」、「ヌクレオチド」、「ヌクレオチド配列」、「核酸」、「核酸分子」、「核酸配列」、及び「オリゴヌクレオチド」という用語は、互換的に使用され、それぞれの複数形を、各々これら用語が利用される文脈に応じて含むことができる。これらは、デオキシリボヌクレオチド(DNA)またはリボヌクレオチド(RNA)、もしくはこれらの類似体のいずれかの、任意の長さのヌクレオチドのポリマー型を指す。ポリヌクレオチドは、任意の三次元構造を有してもよく、また既知または未知の任意の機能を果たしてもよい。以下はポリヌクレオチドの非限定的な例である:遺伝子または遺伝子断片のコードもしくは非コード領域、連鎖解析から画定される複数の遺伝子座(1つの遺伝子座)、エクソン、イントロン、メッセンジャーRNA(mRNA)、トランスファーRNA(tRNA)、リボソームRNA、リボザイム、低分子干渉RNA(siRNA)、マイクロRNA(miRNA)、核内低分子RNA(snRNA)、cDNA、組換えポリヌクレオチド、分岐鎖ポリヌクレオチド、プラスミド、ベクター、任意の配列の単離DNA(A、B及びZ構造)、PNA、ロックド核酸(LNA)、TNA(トレオーセ核酸)、任意の配列の単離RNA、核酸プローブ、及びプライマー。しばしば近づき難いRNAとも称されるLNAは、修飾RNAヌクレオチドである。LNAヌクレオチドのリボース部分は、2’及び4’炭素を連結するエクストラ架橋で修飾されている。この架橋は、3’−エンド型構造配座中のリボースを「ロック」し、これは、頻繁に、DNAまたはRNAのA型で見出され、熱安定性を著しく改善することができる。
「ポリペプチド」、「ペプチド」及び「タンパク質」という用語は、任意の長さのアミノ酸のポリマーを指すために、本明細書で互換的に使用される。このポリマーは、直線状であってもよく、これは修飾アミノ酸を含んでもよく、また非アミノ酸によって割り込まれてもよい。この用語は、修飾されたアミノ酸ポリマー、例えば、ジスルフィド結合形成、グリコシル化、脂質化、アセチル化、リン酸化、または標識成分との結合などの任意の他の操作も包含する。本明細書で使用される場合、「アミノ酸」という用語は、グリシン及びDまたはL光学異性体の両方、ならびにアミノ酸類似体及びペプチド模倣物を含む、天然及び/または非天然もしくは合成アミノ酸のいずれかを指す。
本明細書で使用される場合、2つの核酸配列の文脈における「配列同一性」または「同一性」は、配列比較アルゴリズムによってまたは目視検査によって測定されるとき、指定された比較ウインドウにわたって最大一致について整列されるときに、同一である2つの配列中の残基の特定の百分率に言及するものである。配列同一性の百分率が、タンパク質を参照して使用される場合、同一ではない残基位置が、保存的アミノ酸置換によってしばしば異なり、ここではアミノ酸残基が、同様な化学的性質(例えば、電荷または疎水性)を有するアミノ酸残基で置き換えられており、したがって、分子の機能的特性を変更しないことが認識される。保存的置換において配列が異なる場合、配列同一性パーセントは、置換の保存的性質を補正するために上方修正されてもよい。このような保存的置換によって異なる配列は、「配列類似性」または「類似性」を有するといわれる。この調整を行うための任意の好適な手段が用いられてもよい。これは、完全ミスマッチよりはむしろ部分的ミスマッチとして保存的置換をスコア付けすることを伴ってもよい。したがって、例えば、同一のアミノ酸に1のスコアが与えられ、非保存的置換に0のスコアが与えられる場合、保存的置換は、0〜1のスコアが与えられる。保存的置換のスコア付け、例えば、プログラムPC/GENE(Intelligenetics,Mountain View,Calif.)によって実行されて、算出される。
本明細書で使用される場合、「配列同一性の百分率」とは、2つの最適に整列された配列を比較ウインドウにわたって比較することによって決定される値を意味し、2つの配列の最適なアライメントのために、比較ウインドウ中のポリヌクレオチド配列の一部は、参照配列(付加または欠失を含まない)と比較すると付加または欠失(すなわち、ギャップ)を含む。百分率は、両配列中で同一の核酸塩基またはアミノ酸残基が生じる位置の個数を決定し、マッチした位置の個数を得て、マッチした位置の個数を比較ウインドウにおける位置の総数で割り、この結果に100を掛けて、配列同一性の百分率を得る。
比較のための配列のアライメントの任意の好適な方法が使用されてもよい。したがって、任意の2つの配列間の同一性パーセントの決定は、数学的アルゴリズムを用いて達成することができる。このような数学的アルゴリズムの好ましい非限定的な例は、その全体が参照として本明細書に組み込まれる、Myers and Miller,CABIOS,4:11(1988)のアルゴリズム;その全体が参照として本明細書に組み込まれる、Smith et al.,Adv.Appl.Math.,2:482(1981)のローカルホモロジーアルゴリズム;その全体が参照として本明細書に組み込まれる、Needleman and Wunsch,JMB,48:443(1970)のホモロジーアライメントアルゴリズム;その全体が参照として本明細書に組み込まれる、Pearson and Lipman,Proc.Natl.Acad.Sci.USA,85:2444(1988)の類似性検索法(search−for−similarity−method);その全体が参照として本明細書に組み込まれる、Karlin and Altschul,Proc.Natl.Acad.Sci.USA,87:2264(1990)のアルゴリズム;その全体が参照として本明細書に組み込まれる、Karhn and Altschul,Proc.Natl.Acad.Sci.USA,90:5873(1993)などの改変されたものである。
これらの数学的アルゴリズムのコンピュータ実装は、配列同一性を決定するために、配列の比較のために利用することができる。このような実装としては、PC/Geneプログラム中のCLUSTAL(Intelligenetics,Mountain View,Calif.から入手可能);ALIGNプログラム(バージョン2.0)ならびにWisconsin Genetics Software Package、バージョン8中のGAP、BESTFIT、BLAST、FASTA、及びTFASTA(Genetics Computer Group(GCG),575 Science Drive,Madison,Wis.,USAから入手可能)が挙げられるが、これらに限定されない。これらのプログラムを用いるアライメントは、デフォルトパラメータを用いて実行することができる。CLUSTALプログラムは、それらの全体が参照として本明細書に組み込まれる、Higgins et al.,Gene,73:237(1988)、Higgins et al.,CABIOS,5:151(1989);Corpet et al.,Nucl.Acids Res.,16:10881(1988);Huang et al.,CABIOS,8:155(1992);及びPearson et al.,Meth.Mol.Biol.,24:307(1994)に十分に説明されている。ALIGNプログラムは、上記のMyers及びMillerのアルゴリズムに基づいている。それら全体が参照として本明細書に組み込まれる、Altschul et al.,JMB,215:403(1990);Nucl.Acids Res.,25:3389(1990)のBLASTプログラムは、上記のKarlin及びAltschulのアルゴリズムに基づいている。
BLAST解析を実行するためのソフトウェアは、米国国立バイオテクノロジー情報センター(National Center for Biotechnology Information(NCBI; worldwideweb.ncbi.nlm.nih.gov)を通して公開されている。
本明細書で使用される場合、「発現」とは、ポリヌクレオチドがそれによってmRNA中に転写されるプロセス及び/または転写されたmRNA(「転写物」とも称される)が、それによって、引き続いてペプチド、ポリペプチド、またはタンパク質中に翻訳されるプロセスを指す。転写物及びコード化ポリペプチドは、文脈に応じて、総じて「遺伝子産物」と称される。
「遺伝子」とは、ポリペプチドまたは前駆体の産生に必要な制御及びコード配列を含むポリヌクレオチド配列を指す。ポリペプチドは、全長コード配列によって、またはコード配列の任意の部分によってコードされ得る。遺伝子は、割り込まれていないコード配列を構成してもよく、またはこれは、適切なスプライス部位によって結合された1つ以上のイントロンを含んでもよい。さらには、遺伝子は、コード配列または非翻訳領域のいずれかにおいて1つ以上の改変を含んでもよく、これは、発現産物の生物学的活性または化学的構造、発現の速度、または発現制御の方法に影響を及ぼし得る。このような改変としては、1つ以上のヌクレオチドの突然変異、挿入、欠失、及び置換が挙げられるが、これらに限定されない。この点については、このような改質遺伝子は、「ネイティブ」遺伝子の「変異体」と称されてもよい。
「遺伝子改変」という用語は、異種核酸(すなわち、細胞と外因性である核酸)の細胞への導入後に、細胞中で誘導された永続的または一時的な遺伝子変化を指す。遺伝子変化(「改変」)は、異種核酸の宿主細胞のゲノム中へ組み込みによって、または異種核酸の染色体外因子としての一時的もしくは安定した管理によって達成することができる。細胞が真核細胞である場合、永続的遺伝子変化は、核酸の細胞のゲノムへの導入によって達成することができる。遺伝子改変の好適な方法としては、ウイルス感染、トランスフェクション、接合、原形質融合、電気穿孔法、パーティクルガン技法、リン酸カルシウム析出、直接マイクロインジェクション等が挙げられる。
本明細書で使用される「プロモーター」という用語は、遺伝子の発現(転写)に向けるDNAの配列を指す。プロモーターは、原核または真核遺伝子の転写に向けてもよい。プロモーターは、誘導剤に応答して転写を開始する「誘導性」であってもよく、または対照的に、プロモーターは、これに従って誘導剤が転写の速度を調節しない「構成的」であってもよい。プロモーターは、組織特異的または組織に好ましい方法で調節することができ、それにより、特定の1つの組織型または複数の組織型において作動可能に連結されたコード領域を転写することのみで、これは活性である。
「作動可能に連結された」という用語は、制御配列とコード配列との間の機能的連携を指す。このように記述される成分は、したがって、それらがそれらの意図された方法で機能することを可能にする関係にある。例えば、プロモーターの調節制御下に配置することは、コード配列の発現がプロモーターによって制御されるようにコード配列を位置付けることを意味する。
本明細書で使用される場合、ヌクレオチドまたはアミノ酸配列の終端または末端に関する「終端」または「末端」は、ヌクレオチド配列の5’または3’末端、もしくはアミノ酸配列のアミノまたはカルボキシル末端を指す。したがって、ヌクレオチド配列またはポリペプチド配列の終端にある配列は、ヌクレオチド配列の最も5’側にあるかまたは最も3’側にあるヌクレオチドを含む、もしくはポリペプチド配列のアミノまたはカルボキシル末端を含む配列である。
光反応性であるポリペプチドまたはタンパク質に関する「光活性化」、「光反応性」は、互換的に使用され、光反応性イオンチャネルまたはオプシン、及び本明細書に記載されるイオンポンプを含む。このような光反応性タンパク質は、細胞の形質膜上でこのタンパク質が活性化タンパク質のイオン透過性と形質膜にわたって存在する電気化学的勾配とに応じて発現する細胞に対する、脱分極または過分極効果を有することができる。
本発明を更に説明する前に、本発明は、記載される特定の実施形態に限定されるものではなく、当然のことながら変化し得ることを理解するべきである。本明細書に使用される専門用語は、本発明の範囲が、添付の特許請求の範囲によってのみ限定されるであろうことから、特定の実施形態を説明する目的のものにすぎず、また限定することを意図するものではないことも理解するべきである。
値の一定の範囲が提供される場合、文脈上他の明確な指示がない限り、下限から10番目の単位のところまでの各介在値、この範囲の上限と下限との間の各介在値、及びその記載された範囲内の任意の他の記載される値もしくは介在する値が、本発明の範囲内に包含されることが理解される。これらのより小さな範囲の上限及び下限は、独立して、このより小さな範囲内に含まれてもよく、記載された範囲内の具体的に除外された限界に従って、本発明の範囲内に包含される。記載された範囲が、これら限界の一方または双方を含む場合、これらの包含される限界のいずれかまたは双方を除外する範囲も、本明細書に含まれる。
他に別段の定めがない限り、本明細書で使用される全ての技術用語及び科学用語は、本発明が属する技術分野の当業者によって通常理解されるものと同じ意味を有する。本明細書に記載されるものと同様もしくは等価である任意の方法または材料が、本発明の実行または試験で使用することも可能であるが、好ましい方法及び材料がここで記載される。本明細書で言及される全ての刊行物は、その刊行物が引用するものと関連付けて方法及び/または材料を開示かつ説明するために、参照として本明細書に組み込まれる。
本明細書及び添付の特許請求の範囲で使用される場合、単数形「1つの(a)」、「1つの(an)」、及び「その(the)」は、文脈上他の明確な指示がない限り、複数の指示物を含むことに留意するべきである。したがって、例えば、「遺伝子改変宿主細胞(a genetically modified host cell)」に対する言及は、複数のこのような遺伝子改変宿主細胞を含み、「神経細胞(the neuronal cell)」に対する言及は、1つ以上の神経細胞及び当業者に既知のそれらの等価物への言及を含むことなどである。特許請求の範囲は、いかなる任意の要素も除外するように立案され得ることもさらに留意される。このように、この記述は、例えば「ただ単に(solely)」、「単に(only)」等のこのような排他的な用語の使用のための、または「消極的な」限定の使用のための先行詞(antecedent basis)としての役目を果たすように意図される。
明確にするために別の実施形態の文脈で記載される、本発明のある特定の特徴は、単一の実施形態で組み合わせて提供されてもよいことが理解される。逆に、本発明の様々な特徴で、簡潔にするために、単一の実施形態の文脈で記載されるものは、別個にまたは任意の好適な部分的組合せで提供されてもよい。本発明に係る実施形態の全ての組み合わせは、本発明によって包含され、またありとあらゆる組み合わせがあたかも個別かつ明示的に本明細書に開示されるように本明細書に開示される。加えて、様々な実施形態及びそれらの要素の全ての部分的組合せも、本発明によって具体的に包含され、またありとあらゆる部分的組み合わせがあたかも個別かつ明示的に本明細書に開示されるように本明細書に開示される。
本明細書で論議される刊行物は、ただ単にそれらの開示が本出願の出願日よりも前であるために提供されている。本明細書に記載されるいかなる内容も、本発明が、先行発明のためにこのような刊行物に先行する権利があることを認めるものとしては解釈されるべきではない。さらに、提示される刊行物の日付は、実際の刊行日付とは異なる場合があり、これらは個々に確認する必要がある。
詳細な説明
ドーパミン受容体2型特異的プロモーター(D2SP)を含む核酸及び関心対象の標的細胞中でポリペプチドを発現させるためにこの核酸を使用する方法が提供される。本開示の態様は、D2SPを含む核酸を含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、コザック配列を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列(図2)と少なくとも95%の配列同一性を有するヌクレオチド配列を含む。
いくつかの実施形態において、対象の核酸は、D2SPを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、コザック配列を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含む。
ある特定の実施形態において、対象の核酸は、D2SPを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列を含み、このD2SPは、コザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含む。
ある特定の実施形態において、対象の核酸は、D2SPを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列を含み、このD2SPは、コザック配列の5’に位置するBamHI制限部位を含み、このD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、またこのD2SPは、遺伝子産物をコードするヌクレオチド配列に作動可能に連結されている。場合によっては、遺伝子産物は、ポリペプチドである。場合によっては、遺伝子産物は、ポリヌクレオチドである。場合によっては、遺伝子産物は、蛍光タンパク質;遺伝的にコードされたインジケーター;光反応性ポリペプチド;リコンビナーゼ;またはこれらの組み合わせなどの検出可能なシグナルを提供するポリペプチドである。
ある特定の実施形態において、対象の核酸は、D2SPを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列を含み、このD2SPは、コザック配列の5’に位置するBamHI制限部位を含み、このD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、またこのD2SPは、SEQ ID NO:4〜54のポリペプチドから選択される光反応性ポリペプチドをコードするヌクレオチド配列に作動可能に連結されている。
ある特定の実施形態において、対象の核酸は、D2SPを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列を含み、このD2SPは、コザック配列の5’に位置するBamHI制限部位を含み、このD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、またこのD2SPは、緑色蛍光タンパク質、黄色蛍光タンパク質、シアン蛍光タンパク質、カルシウムインジケーター、及び電圧インジケーターから選択される蛍光タンパク質をコードするヌクレオチド配列に作動可能に連結されている。
D2SPを含む核酸を含む組換え発現ベクターも本明細書に提供され、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、コザック配列を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含む。
ある特定の実施形態において、組換え発現ベクターは、D2SPを含む核酸を含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列を含み、このD2SPは、コザック配列の5’に位置するBamHI制限部位を含み、このD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、またこのD2SPは、遺伝子産物をコードするヌクレオチド配列に作動可能に連結されている。場合によっては、遺伝子産物は、蛍光タンパク質;遺伝的にコードされたインジケーター;光反応性ポリペプチド;リコンビナーゼ;またはこれらの組み合わせなどの検出可能なシグナルを提供するポリペプチドである。
D2SPを含む核酸を含む遺伝子改変宿主細胞も本明細書に提供され、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、コザック配列を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含む。場合によっては、この核酸は、遺伝子改変宿主細胞において組換え発現ベクター中に含まれる。
ある特定の実施形態において、本開示の遺伝子改変宿主細胞は、D2SPを含む核酸を含む組換え発現ベクターを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列を含み、このD2SPは、コザック配列の5’に位置するBamHI制限部位を含み、このD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、またこのD2SPは、遺伝子産物をコードするヌクレオチド配列に作動可能に連結されている。場合によっては、遺伝子産物は、蛍光タンパク質;遺伝的にコードされたインジケーター;光反応性ポリペプチド;リコンビナーゼ;またはこれらの組み合わせなどの検出可能なシグナルを提供するポリペプチドである。
標的ニューロンの活性を調節する方法も本明細書に提供され、本方法は、D2SPを含む核酸を標的ニューロンに導入することを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列及びコザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、このD2SPは、光によって活性化されたときに標的ニューロンの過分極または脱分極を誘導する光反応性ポリペプチドに作動可能に連結されている。
標的ニューロンの活性を調節する方法も本明細書に提供され、本方法は、D2SPを含む核酸を標的ニューロンに導入することを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列及びコザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、このD2SPは、光によって活性化されたときに標的ニューロンの脱分極を誘導する、SEQ ID NO:4〜23のうちのいずれか1つに記載されるアミノ酸配列を含む光反応性ポリペプチドに作動可能に連結されている。
標的ニューロンの活性を調節する方法も本明細書に提供され、本方法は、D2SPを含む核酸を標的ニューロンに導入することを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列及びコザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、このD2SPは、光によって活性化されたときに標的ニューロンの過分極を誘導する、SEQ ID NO:24〜54のうちのいずれか1つに記載されるアミノ酸配列を含む光反応性ポリペプチドに作動可能に連結されている。
標的細胞を蛍光標識する方法も本明細書に提供され、本方法は、D2SPを含む核酸を標的細胞に導入することを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列及びコザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、このD2SPは、発現したときに標的細胞を蛍光標識する蛍光タンパク質に作動可能に連結されている。
ある特定の実施形態において、標的細胞を蛍光標識する本開示の方法は、D2SPを含む核酸を標的ニューロンに導入することを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列及びコザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、このD2SPは、発現したときに標的ニューロンを蛍光標識する蛍光タンパク質に作動可能に連結されている。
ある特定の実施形態において、標的細胞を蛍光標識する本開示の方法は、D2SPを含む核酸を標的前駆細胞に導入することを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列及びコザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、このD2SPは、発現したときに標的前駆細胞を蛍光標識する蛍光タンパク質に作動可能に連結されている。
ある特定の実施形態において、標的細胞を蛍光標識する本開示の方法は、D2SPを含む核酸を標的幹細胞に導入することを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端においてコザック配列及びコザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含み、このD2SPは、発現したときに標的幹細胞を蛍光標識する蛍光タンパク質に作動可能に連結されている。
本開示のさらなる態様はここでより詳細に以下に説明されるであろう。
核酸
ドーパミン受容体2型特異的プロモーター(D2SP)
上で概説したように、本開示の態様は、D2SP、すなわち、2型ドーパミン(D2)受容体を発現する細胞中のプロモーターに動作可能に連結された遺伝子の発現を指示するプロモーター配列を含む核酸を含む。ある特定の実施形態において、D2SPは、ゲノム中のD2受容体の第1のエクソンのゲノム配列5’に由来する。
ある特定の実施形態において、D2受容体は、ラット、マウス、サル、非ヒト霊長類またはヒトゲノムが挙げられるが、これらに限定されない哺乳動物ゲノムに由来する。
いくつかの実施形態において、D2SPは、D2受容体の第1のエクソンの5’に存在するゲノム配列に由来する。したがって、いくつかの実施形態において、D2SPは、3.0キロベース(kb)以下、例えばD2受容体の第1のエクソンの開始点の1.6kb以下の5’を含む、2.0kb以下などの2.5kb以下を開始するゲノム配列に由来する。他の実施形態において、D2SPは、0.5キロベース(kb)以上、例えばD2受容体の第1のエクソンの開始点の1.5kb以上の5’を含む、1.2kb以上などの1.0kb以上を開始するゲノム配列に由来する。ある特定の実施形態において、D2SPは、D2受容体の第1のエクソンの開始点または転写開始点の3.0〜0.5kb、例えば2.5kb〜1.0kb、または2.0kb〜1.2kb5’の範囲で開始するゲノム配列に由来する。
遺伝子の転写開始点、または第1のエクソンの開始点は、本明細書で互換的に使用され、遺伝子をコードする遺伝子座から転写された成熟RNA(mRNA)の5’末端として定義されてもよい。したがって、ある特定の実施形態において、D2受容体の第1のエクソンの開始点は、D2受容体ゲノム遺伝子座から転写されたmRNAの5’末端によって定義される。ある特定の実施形態において、D2受容体の第1のエクソンの開始点は、GenBankアクセッション番号:NM_012547(ドブネズミ(Rattus norvegicus));NM_010077(ハツカネズミ(Mus musculus));またはNM_000795(ヒト(Homo sapiens))によって表される配列によって定義される。
ある特定の実施形態において、D2SRの長さは、500塩基対(bp)〜2500bp、例えば、750bp〜2250bp、1000bp〜2000bp、例えば1250bp〜1750bpである。場合によっては、D2SRの長さは、500bp以上、例えば、750bp以上、1000bp以上、1250bp以上、1350bp以上、1450bp以上、1500bp以上、1510bp以上、1520bp以上、または1530bp以上である。場合によっては、D2SRの長さは、2000bp以下、例えば、1750bp以下、1700bp以下、1650bp以下、1600bp以下、1590bp以下、1580bp以下、1570bp以下、1560bp以下、または1550bp以下である。別の実施形態において、D2SRの長さは、約1540bpである。
本開示の態様は、D2受容体遺伝子のエクソン1を含まないD2SPを含む核酸を含む(図1)。D2受容体遺伝子は、任意の哺乳動物D2受容体遺伝子であってもよく、これらとしてはラットD2受容体遺伝子(GeneID 24318)、マウスD2受容体遺伝子(GeneID 13489)またはヒトD2受容体遺伝子(GeneID 1813)が挙げられるが、これらに限定されない。他の哺乳動物D2受容体遺伝子としては、サル及び非ヒト霊長類D2受容体遺伝子が含まれる。D2受容体遺伝子の第1のエクソンを決定するための任意の好適な方法が用いられてもよい。ある特定の実施形態において、ラットD2受容体遺伝子のエクソン1は、SEQ ID NO:3(図15)に示される配列と80%以上、例えば、85%以上、90%以上、95%以上、98%以上、99%以上、または100%同一である配列によって定義される。したがって、ある特定の実施形態において、D2SPは、SEQ ID NO:3(図15)に示される配列と80%以上、例えば、85%以上、90%以上、95%以上、98%以上、99%以上、または100%同一である配列を含まない。ある特定の実施形態において、D2SPは、SEQ ID NO:3(図15)に示される配列のヌクレオチド1〜313、例えば、ヌクレオチド1〜300、ヌクレオチド1〜250、ヌクレオチド1〜200、ヌクレオチド1〜150、ヌクレオチド1〜100、ヌクレオチド1〜90、ヌクレオチド1〜80、ヌクレオチド1〜70、ヌクレオチド1〜60、ヌクレオチド1〜50、ヌクレオチド1〜40、例えばヌクレオチド1〜30と90%以上、例えば95%以上、98%以上、99%以上、または100%同一であるヌクレオチド配列を含まない。ある特定の実施形態において、D2SPは、SEQ ID NO:3(図15)に示される配列のヌクレオチド1〜270と90%以上、例えば、95%以上、98%以上、99%以上、または100%同一であるヌクレオチド配列を含まない。
本開示のさらなる態様は、コザック配列を含むD2SPを含む核酸を含む。「コザック配列」という用語は、翻訳の開始のために、mRNAのリボソームの小サブユニットへの初期結合を容易にするための配列を指す。例示のコザック配列はGCCRCCであり、式中、Rはプリン(AまたはG)である。ある特定の実施形態において、コザック配列はGCCACCである。ある特定の実施形態において、コザック配列が機能するための能力に大きく影響を及ぼすことなく、1つ、2つ、3つ、またはそれ以上のヌクレオチドは、例示のコザック配列において置換されてもよい(Kozak,M.,Cell,44(2):283−92,1986;Kozak,M.Nucleic Acids Res.,Oct 26;15(20):8125−48,1987;Kozak,M,J.Biol.Chem.,266(30):19867−19870,1991)。
ある特定の実施形態において、コザック配列は、D2SPの3’末端、または端部に位置する。したがって、D2SPが、ポリペプチドをコードするRNA転写物の発現を指示するある特定の実施形態において、ポリペプチドに対するコード配列は、D2SPの終端の3’のすぐ近くで開始する。第2の配列のすぐ隣に存在する第1の配列に関して本明細書で使用される「すぐ近く」は、第1と第2の配列との間に介在する配列がないこと(すなわち、ヌクレオチドまたはアミノ酸がないこと)を示す。したがって、ある特定の実施形態において、コザック配列は、そのすぐ後の3’にコード配列の開始コドン(すなわち、ヌクレオチド配列ATG)が続く。
ある特定の実施形態において、D2SPは、制限ヌクレアーゼに対する認識部位を含む。ある特定の実施形態において、この制限ヌクレアーゼはBamHIである。BamHIの認識部位は、GGATCCである。したがって、ある特定の実施形態において、D2SPは、GGATCCの配列によって定義されるBamHI認識部位を含む。ある特定の実施形態において、BamHI認識部位は、コザック配列の5’に位置する。ある特定の実施形態において、BamHI部位は、コザック配列の5’のすぐ近くに位置する。いくつかの実施形態において、BamHI制限部位は、D2SPが由来するD2受容体ゲノム遺伝子座のゲノム配列の3’に位置する。したがって、ある特定の実施形態において、BamHI制限部位は、D2SPが由来するD2受容体ゲノム遺伝子座のゲノム配列の3’かつコザック配列の5’に位置する。
ある特定の実施形態において、D2SPは、SEQ ID NO:1(図2)に記載されるヌクレオチド配列と少なくとも75%、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含む。したがって、本開示の一態様は、D2SPを含む核酸を含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、コザック配列を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含む。別の態様において、対象の核酸は、D2SPを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、コザック配列及びBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含む。ある特定の実施形態において、この核酸はD2SPを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、D2SPの3’末端にコザック配列を、及びコザック配列の5’に位置するBamHI制限部位を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも75%の、例えば、少なくとも80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するヌクレオチド配列を含む。
ある特定の実施形態において、D2SPは、遺伝子産物をコードするヌクレオチド配列に作動可能に連結されている。遺伝子産物は、D2受容体を発現する標的細胞において特異的に発現する、用途を見出す任意の好適な遺伝子産物であることができる。ある場合には、遺伝子産物は、ポリペプチドである。ある場合には、遺伝子産物は、ポリヌクレオチドである。ある特定の実施形態において、遺伝子産物は、光反応性ポリペプチドである。ある特定の実施形態において、光反応性ポリペプチドは、標的細胞の細胞膜上で発現して適切な波長及び強度の光への露光によって活性化されたときに標的細胞を脱分極または活性化するポリペプチドである。ある特定の実施形態において、光反応性ポリペプチドは、標的細胞の細胞膜上で発現して適切な波長及び強度の光への露光によって活性化されたときに標的細胞を過分極または阻害するポリペプチドである。対象のD2SPに作動可能に連結され得る例示の光反応性ポリペプチドは、以下にさらに記載されている。
ある特定の実施形態において、D2SPに作動可能に連結された遺伝子産物は、検出可能なシグナルを提供する。検出可能なシグナルは、蛍光、化学発光、酵素活性等であることができる。ある特定の実施形態において、D2SPが作動可能に連結され、検出可能なシグナルを提供する遺伝子産物は、蛍光タンパク質であり、これらとしては、緑色蛍光タンパク質、黄色蛍光タンパク質、シアン蛍光タンパク質等が挙げられるが、これらに限定されない。いくつかの実施形態において、D2SPが作動可能に連結され、検出可能なシグナルを提供する遺伝子産物は、遺伝的にコードされたインジケーターであり、例えば、限定されるものではないが、カルシウムインジケーターまたは電圧インジケーターである。カルシウムインジケーターは、1つ以上のカルシウムイオンに結合するように操作された蛍光ポリペプチドであり、蛍光特性、例えばカルシウムイオンの結合が、ポリペプチドの強度、励起及び/または発光波長等を変更する。任意の好適なカルシウムインジケーターが、標的細胞中で検出可能なシグナルを提供するために用いられてもよい。場合によっては、カルシウムインジケーターは、カメレオン及びその誘導体などの供給電圧比例型(ratiometric)カルシウムインジケーターである。関心対象の他のカルシウムインジケーターとしては、GCaMP1、GCaMP2、GCaMP3、及びこれらの誘導体、ならびに参照として本明細書に組み込まれる、米国特許第8,629,256号、及びTian et al.,2012 Prog Brain Res,196:79に列記されたものが挙げられるが、これらに限定されない。電圧インジケーターは、膜電位における変化に応答するように操作されている蛍光ポリペプチドであり、膜電位における変化は、ポリペプチドの強度、励起及び/または発光波長等を変更する。任意の好適な電圧インジケーターが、標的細胞中で検出可能なシグナルを提供するために用いられてもよい。関心対象の電圧インジケーターとしては、QuasAr1、QuasAr2、VSFP、及びこれらの誘導体、ならびに参考として本明細書に組み込まれる、米国特許出願公開第20130224756号、Hochbaum et al.,Nat Methods 2014 11:825,Baker et al.,Brain Cell Biol 2008 36:53;及びMutoh et al.,Exp Physiol 2011 96:13に列記されたものが挙げられるが、これらに限定されない。
ある特定の実施形態において、D2SPは、リコンビナーゼをコードするヌクレオチド配列に作動可能に連結されている。D2SPに作動可能に連結され得る任意の好適なリコンビナーゼを使用することができる。好適なリコンビナーゼとしては、Cre及びFlpリコンビナーゼ、及びこれらの誘導体が挙げられるが、これらに限定されない。リコンビナーゼ及び標的核酸との部位特異的組換えを誘導することにおけるその使用は、例えば、参照として本明細書に組み込まれる、米国特許出願公開第20130019325号及び同第20060003443号、米国特許第8,518392号ならびにWu et al.,PLoS One 2009 4:e8054に記載されている。
光反応性ポリペプチド
上で概説したように、本開示の態様は、光反応性ポリペプチドをコードするヌクレオチド配列に作動可能に連結されたD2SPを含む。光活性化イオンチャネルポリペプチドは、このポリペプチドが活性化波長の光で照射されるとき、1つ以上のイオンに標的細胞の形質膜を通過させるように適合される。光活性化タンパク質は、光のプロトンごとに少数のイオンの形質膜の通過を容易にするイオンポンプタンパク質として、またはチャネルが開かれるとき、イオンの流れが形質膜を通って自由に流れることを可能にするイオンチャネルタンパク質として特徴付けられてもよい。いくつかの実施形態において、光反応性ポリペプチドは、活性波長の光によって活性化されたときに標的細胞を脱分極する。いくつかの実施形態において、光反応性ポリペプチドは、活性波長の光によって活性化されたときに標的細胞を過分極する。
いくつかの実施形態において、光反応性ポリペプチドは青色光によって活性化される。いくつかの実施形態において、光反応性ポリペプチドは緑色光によって活性化される。いくつかの実施形態において、光反応性ポリペプチドは黄色光によって活性化される。いくつかの実施形態において、光反応性ポリペプチドは橙色光によって活性化される。いくつかの実施形態において、光反応性ポリペプチドは赤色光によって活性化される。
いくつかの実施形態において、細胞中で発現する光反応性ポリペプチドは、シグナルペプチド、小胞体(ER)輸送シグナル、膜トラフィッキング(trafficking)シグナル、及び/またはN末端ゴルジ輸送シグナルからなる群から選択される1つ以上のアミノ酸配列モチーフに融合することができる。哺乳動物細胞の形質膜への光反応性タンパク質の輸送を向上させる1つ以上のアミノ酸配列モチーフは、光反応性ポリペプチドのN末端、C末端、またはN末端及びC末端の両方に融合することができる。ある場合には、哺乳動物細胞の形質膜への光反応性タンパク質の輸送を向上させる1つ以上のアミノ酸配列モチーフは、光反応性ポリペプチドの内部に融合される。任意に、光反応性ポリペプチド及び1つ以上のアミノ酸配列モチーフは、リンカーによって分離されてもよい。
いくつかの実施形態において、光反応性ポリペプチドは、タンパク質の細胞形質膜への輸送を向上させるトラフィッキングシグナル(ts)の付加によって改変されてもよい。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来することができる。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含むことができる。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
などのアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するアミノ酸配列を含むことができる。
トラフィッキング配列は、約10個のアミノ酸〜約50個のアミノ酸、例えば約10個のアミノ酸〜約20個のアミノ酸、約20個のアミノ酸〜約30個のアミノ酸、約30個のアミノ酸〜約40個のアミノ酸、または約40個のアミノ酸〜約50個のアミノ酸の長さを有することができる。
光反応性ポリペプチドに好適であるER輸送配列としては、
等が含まれる。ER輸送配列は、約5個のアミノ酸〜約25個のアミノ酸、例えば約5個のアミノ酸〜約10個のアミノ酸、約10個のアミノ酸〜約15個のアミノ酸、約15個のアミノ酸〜約20個のアミノ酸、または約20個のアミノ酸〜約25個のアミノ酸の長さを有することができる。
使用するために好適であるシグナル配列は、1)hChR2のシグナルペプチド
2)ニューロンニコチン性アセチルコリン受容体のβ2サブユニットシグナルペプチド
3)ニコチン性アセチルコリン受容体シグナル配列
及び4)ニコチン性アセチルコリン受容体シグナル配列
のうちの1つなどのアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%の配列同一性を有するアミノ酸配列を含むことができる。
シグナル配列は、約10個のアミノ酸〜約50個のアミノ酸、例えば約10個のアミノ酸〜約20個のアミノ酸、約20個のアミノ酸〜約30個のアミノ酸、約30個のアミノ酸〜約40個のアミノ酸、または約40個のアミノ酸〜約50個のアミノ酸の長さを有することができる。
いくつかの実施形態において、タンパク質中のシグナルペプチド配列は、欠失され得るか、または異なるタンパク質からのシグナルペプチド配列で置き換えられ得る。
例示の光反応性ポリペプチドは、例えば、PCT出願番号PCT/US2011/028893に記載され、これは、参考として本明細書に組み込まれる。本開示における用途を見出す代表的な光反応性ポリペプチドは、以下にさらに記載される。
脱分極性光反応性ポリペプチド
ChR
いくつかの実施形態において、脱分極性光反応性ポリペプチドは、コナミドリムシ(Chlamydomonas reinhardtii)に由来し、このポリペプチドは、細胞が光によって照射されるとき、カチオンを、細胞膜を横切って輸送することができる。別の実施形態において、光反応性ポリペプチドは、SEQ ID NO:4に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。コナミドリムシに由来する光反応性カチオンチャネルタンパク質を活性化するために使用される光は、約460〜約495nmの波長を有するか、または約480nmの波長を有する。さらに、約100Hzの時間周波数を有する光パルスが、光反応性タンパク質を活性化するために使用することができる。いくつかの実施形態において、約100Hzの時間周波数を有する光パルスによるコナミドリムシに由来する光反応性カチオンチャネルタンパク質の活性化は、光反応性カチオンチャネルを発現するニューロンの脱分極を引き起こすことが可能である。光反応性カチオンチャネルタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/または光反応性カチオンチャネルタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、光反応性カチオンチャネルタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有する光反応性プロトンポンプタンパク質は、細胞膜を横切ってカチオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のT159C置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のL132C置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のE123T置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のE123A置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のT159C置換及びE123T置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のT159C置換及びE123A置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のT159C置換、L132C置換、及びE123T置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のT159C置換、L132C置換、及びE123A置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のL132C置換及びE123T置換を含む。いくつかの実施形態において、光反応性カチオンチャネルは、SEQ ID NO:4に記載されるアミノ酸配列のL132C置換及びE123A置換を含む。
いくつかの実施形態において、ChR2タンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上)のアミノ酸配列モチーフを含む。いくつかの実施形態において、ChR2タンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、ChR2タンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、ChR2タンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、ChR2タンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかを含むことができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来し得る。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列KSRITSEGEYIPLDQIDINV(SEQ ID NO:56)を含むことができる。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、ChR2タンパク質は、SEQ ID NO:5に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を有することができる。
他の実施形態において、光反応性ポリペプチドは、タンパク質のレチナール結合ポケット内の重要な位置における特異的アミノ酸置換を有し得る階段関数オプシン(step function opsin)(SFO)タンパク質または安定化階段関数オプシン(stabilized step function opsin)(SSFO)タンパク質である。いくつかの実施形態において、SFOタンパク質は、SEQ ID NO:4のアミノ酸残基C128において突然変異を有することができる。他の実施形態において、SFOタンパク質は、SEQ ID NO:4中にC128A突然変異を有する。他の実施形態において、SFOタンパク質は、SEQ ID NO:4中にC128S突然変異を有する。別の実施形態において、SFOタンパク質は、SEQ ID NO:4中にC128T突然変異を有する。
いくつかの実施形態において、SSFOタンパク質は、SEQ ID NO:4のアミノ酸残基D156において突然変異を有することができる。他の実施形態において、SSFOタンパク質は、SEQ ID NO:4の両方のアミノ酸残基C128及びD156において突然変異を有することができる。一実施形態において、SSFOタンパク質は、SEQ ID NO:4中にC128S及びD156A突然変異を有する。別の実施形態において、SSFOタンパク質は、SEQ ID NO:6に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含むことができ、アミノ酸128においてアラニン、セリン、またはスレオニンを含み、アミノ酸156においてアラニンを含む。別の実施形態において、SSFOタンパク質は、SEQ ID NO:4中にC128T突然変異を含むことができる。いくつかの実施形態において、SSFOタンパク質は、SEQ ID NO:6中のC128T及びD156Aを含む。
いくつかの実施形態において、本明細書に提供されるSFOまたはSSFOタンパク質は、細胞が青色光で照射されるとき、細胞中の脱分極電流を仲介する能力を有し得る。他の実施形態において、この光は、約445nmの波長を有し得る。さらに、いくつかの実施形態において、この光はSFO及びSSFO光電流の長期安定性のために、光の単一パルスとして、または光の間隔をあけたパルスとして送出することができる。いくつかの実施形態において、SFOまたはSSFOタンパク質の光の単一パルスもしくは間隔をあけたパルスによる活性化は、SFOまたはSSFOタンパク質を発現するニューロンの脱分極を引き起こすことができる。いくつかの実施形態において、開示された段階関数オプシン及び安定化段階関数オプシンタンパク質のそれぞれは、光に反応して神経細胞の膜を脱分極することで使用するための特異性及び特性を有することができる。
SFOまたはSSFOタンパク質に関連するさらなる開示は、国際特許出願公報番号WO2010/056970で見出すことができ、この開示は、その全体が参考として本明細書に組み込まれる。
ある場合には、ChR2ベースのSFOまたはSSFOは、膜トラフィッキングシグナル及び/またはER輸送シグナルを含む。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用に好適であるトラフィックイング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列(例えば、
)などのアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含む。ある場合には、ER輸送シグナルは、例えば、
等である。
ある特定の実施形態において、SSFOタンパク質は、SEQ ID NO:7に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
ボルボックス・カルテリ(Volvox carteri)光反応性ポリペプチド
いくつかの実施形態において、好適な光反応性ポリペプチドは、ボルボックス・カルテリに由来するカチオンチャネル(VChR1)であり、約500nm〜約600nm、例えば約525nm〜約550nm、例えば545nmの波長の光による照射によって活性化される。いくつかの実施形態において、光反応性イオンチャネルタンパク質は、SEQ ID NO:8に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。光反応性イオンチャネルタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/または光反応性イオンチャネルタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、光反応性イオンチャネルタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有する光反応性イオンチャネルタンパク質は、光に反応して神経細胞の形質膜を横切ってイオンを輸送するための能力を適切に保持する。
ある場合には、VChR1光反応性カチオンチャネルタンパク質は、SEQ ID NO:8に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のコアアミノ酸配列と、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、哺乳動物細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上など)のアミノ酸配列モチーフとを含む。いくつかの実施形態において、光反応性プロトンイオンチャネルは、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、光反応性イオンチャネルタンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、光反応性イオンチャネルタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、光反応性イオンチャネルタンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列(例えば、
)のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、VChR1タンパク質は、SEQ ID NO:9に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
VChR1に基づく段階関数オプシン及び安定化段階関数オプシン
他の実施形態において、光反応性ポリペプチドは、VChR1に基づくSFOまたはSSFOである。いくつかの実施形態において、SFOタンパク質は、SEQ ID NO:8のアミノ酸残基C123において突然変異を有することができる。他の実施形態において、SFOタンパク質は、SEQ ID NO:8中にC123A突然変異を有する。他の実施形態において、SFOタンパク質は、SEQ ID NO:8中にC123S突然変異を有する。別の実施形態において、SFOタンパク質は、SEQ ID NO:8中にC123T突然変異を有する。
いくつかの実施形態において、SFOタンパク質は、SEQ ID NO:8のアミノ酸残基D151において突然変異を有することができる。他の実施形態において、SFOタンパク質は、SEQ ID NO:8の両方のアミノ酸残基C123及びD151において突然変異を有することができる。一実施形態において、SFOタンパク質は、SEQ ID NO:8中にC123S及びD151A突然変異を有する。
いくつかの実施形態において、SFOまたはSSFOタンパク質は、細胞が青色光で照射されるとき、細胞中の電流の脱分極を仲介する能力を有し得る。いくつかの実施形態において、この光は、約560nmの波長を有する。さらに、いくつかの実施形態において、この光はSFO及びSSFO光電流の長期安定性のために、光の単一パルスとして、または光の間隔をあけたパルスとして送出される。いくつかの実施形態において、SFOまたはSSFOタンパク質の光の単一パルスもしくは間隔をあけたパルスによる活性化は、SFOまたはSSFOを発現するニューロンの脱分極を引き起こすことができる。いくつかの実施形態において、開示された段階関数オプシン及び安定化段階関数オプシンタンパク質のそれぞれは、光に反応して神経細胞の膜を脱分極することで使用するための特異性及び特性を有することができる。
ある場合には、VChR1ベースのSFOまたはSSFOは、膜トラフィッキングシグナル及び/またはER輸送シグナルを含む。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。使用に好適であるトラフィックイング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
などのアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含む。ある場合には、ER輸送シグナルは、例えば、
等である。
C1V1キメラカチオンチャネル
他の実施形態において、光反応性カチオンチャネルタンパク質は、ボルボックス・カルテリのVChR1タンパク質とコナミドリムシからのChR1タンパク質とに由来するC1V1キメラタンパク質であり、このタンパク質は、ChR1の第1及び第2の膜貫通ヘリックスによって置き換えられた少なくとも第1及び第2の膜貫通ヘリックスを有するVChR1のアミノ酸配列を含み、光と反応性であり、細胞が光によって照射されるとき、細胞中の電流の分極を仲介することができる。いくつかの実施形態において、C1V1タンパク質は、キメラ光反応性タンパク質の第2と第3の膜貫通ヘリックスとの間に位置する細胞内ループドメイン内に置換をさらに含み、細胞内ループドメインの少なくとも一部が、ChR1の対応する部分によって置き換えられている。別の実施形態において、C1V1キメラタンパク質の細胞内ループドメインの一部は、ChR1のアミノ酸残基A145に延びるChR1からの対応する部分で置き換えられ得る。他の実施形態において、C1V1キメラタンパク質は、キメラ光反応性タンパク質の第3の膜貫通ヘリックス内に置換をさらに含み、第3の膜貫通ヘリックスの少なくとも一部が、ChR1の対応する配列によって置き換えられている。さらに別の実施形態において、C1V1キメラタンパク質の細胞内ループドメインの一部は、ChR1のアミノ酸残基W163に延びるChR1からの対応する部分で置き換えられ得る。他の実施形態において、C1V1キメラタンパク質は、SEQ ID NO:10に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
いくつかの実施形態において、C1V1タンパク質は、緑色光によって照射されるとき、細胞中の電流の脱分極を仲介する。いくつかの実施形態において、この光は、約540nm〜約560nmの波長を有する。いくつかの実施形態において、この光は、約542nmの波長を有することができる。いくつかの実施形態において、C1V1キメラタンパク質は、細胞が紫色光によって照射されるとき、細胞中の電流を脱分極することを仲介できない。いくつかの実施形態において、このキメラタンパク質は、細胞が約405nmの波長を有する光によって照射されるとき、細胞中の電流を脱分極することを仲介できない。さらに、いくつかの実施形態において、約100Hzの時間周波数を有する光パルスを、C1V1タンパク質を活性化するために使用することができる。
ある場合には、C1V1ポリペプチドは、膜トラフィッキングシグナル及び/またはER輸送シグナルを含む。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用に好適であるトラフィックイング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
などのアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含む。ある場合には、ER輸送シグナルは、例えば、
等である。
ある特定の実施形態において、C1V1タンパク質は、SEQ ID NO:11に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
C1V1変異体
いくつかの実施形態において、好適な光反応性ポリペプチドは、置換されたまたは変異したアミノ酸配列を含み、変異体ポリペプチドは、前駆体C1V1ポリペプチドの特徴的な光活性化可能な性質を保持するが、いくつかの特定の態様においては変更された特性も有し得る。例えば、本明細書に記載される変異体光反応性C1V1キメラタンパク質は、動物細胞内でまたは動物細胞形質膜上の両方での増加した発現のレベル;異なる波長の光、特に赤色光に露光されたときの変更された反応性;及び/またはこれによってキメラC1V1ポリペプチドが、低脱感作、高速の不活性化、他の光反応性カチオンチャネルとの最小交差活性化のための低紫色光活性化、ならびに/もしくは動物細胞中の強い発現を有する形質の組み合わせを呈することができる。
したがって、好適な光反応性タンパク質は、キメラポリペプチドのVChR1部分のレチナール結合ポケット全体にわたる重要な位置において特異的なアミノ酸置換を有することができるC1V1キメラ光反応性タンパク質を含む。いくつかの実施形態において、C1V1タンパク質は、SEQ ID NO:10のアミノ酸残基E122においてアミノ酸置換を含む。いくつかの実施形態において、C1V1タンパク質は、SEQ ID NO:10のアミノ酸残基E162においてアミノ酸置換を含む。他の実施形態において、C1V1タンパク質は、SEQ ID NO:10のアミノ酸残基E162及びE122の両方においてアミノ酸置換を含む。
いくつかの態様において、C1V1−E122変異体キメラタンパク質は、細胞が光によって照射されるとき、細胞中の電流を脱分極することを仲介できる。いくつかの実施形態において、この光は、緑色光である。他の実施形態において、この光は、約540nm〜約560nmの波長を有する。いくつかの実施形態において、この光は、約546nmの波長を有する。他の実施形態において、C1V1−E122変異体キメラタンパク質は、細胞が赤色光で照射されるとき、細胞中の電流を脱分極することを仲介できる。いくつかの実施形態において、この赤色光は、約630nmの波長を有する。C1V1−E122変異体キメラタンパク質は、細胞が紫色光によって照射されるときは、細胞中の電流を脱分極することを仲介できない。いくつかの実施形態において、このキメラタンパク質は、約405nmの波長を有する光で照射されるときは、細胞中の電流を脱分極することを仲介できない。さらに、いくつかの実施形態において、約100Hzの時間周波数を有する光パルスを、C1V1−E122変異体キメラタンパク質を活性化するために使用することができる。いくつかの実施形態において、C1V1−E122変異体キメラタンパク質の100Hzの周波数を有する光パルスによる活性化は、C1V1−E122変異体キメラタンパク質を発現するニューロンの脱分極化を引き起こし得る。
他の態様において、C1V1−E162変異体キメラタンパク質は、細胞が光によって照射されるとき、細胞中の電流を脱分極することを仲介できる。いくつかの実施形態において、この光は、緑色光とすることができる。他の実施形態において、この光は、約535nm〜約540nmの波長を有することができる。いくつかの実施形態において、この光は、約542nmの波長を有することができる。他の実施形態において、この光は、約530nmの波長を有することができる。いくつかの実施形態において、C1V1−E162変異体キメラタンパク質は、細胞が紫色光で照射されるとき、細胞中の電流を脱分極することを仲介できない。いくつかの実施形態において、このキメラタンパク質は、約405nmの波長を有する光で照射されるときは、細胞中の電流を脱分極することを仲介できない。さらに、いくつかの実施形態において、約100Hzの時間周波数を有する光パルスを、C1V1−E162変異体キメラタンパク質を活性化するために使用することができる。いくつかの実施形態において、C1V1−E162変異体キメラタンパク質の100Hzの周波数を有する光パルスによる活性化は、C1V1−E162変異体キメラタンパク質を発現するニューロンの脱分極誘導シナプス枯渇を引き起こし得る。
さらに他の態様において、C1V1−E122/E162変異体キメラタンパク質は、細胞が光によって照射されるとき、細胞中の電流を脱分極することを仲介できる。いくつかの実施形態において、この光は、緑色光とすることができる。他の実施形態において、この光は、約540nm〜約560nmの波長を有することができる。いくつかの実施形態において、この光は、約546nmの波長を有することができる。いくつかの実施形態において、C1V1−E122/E162変異体キメラタンパク質は、細胞が紫色光で照射されるとき、細胞中の電流を脱分極することを仲介できない。いくつかの実施形態において、このキメラタンパク質は、約405nmの波長を有する光で照射されるときは、細胞中の電流を脱分極することを仲介できない。いくつかの実施形態において、C1V1−E122/E162変異体キメラタンパク質は、E122/E162における突然に変異を欠如するC1V1キメラタンパク質に比べると、または他の光反応性カチオンチャネルタンパク質に比べると、紫色光に露光されたときにより少ない活性化を呈し得る。さらに、いくつかの実施形態において、約100Hzの時間周波数を有する光パルスを、C1V1−E122/E162変異体キメラタンパク質を活性化するために使用することができる。いくつかの実施形態において、C1V1−E122/E162変異体キメラタンパク質の100Hzの周波数を有する光パルスによる活性化は、C1V1−E122/E162変異体キメラタンパク質を発現するニューロンの脱分極誘導シナプス枯渇を引き起こし得る。
ある場合には、C1V1変異体ポリペプチドは、膜トラフィッキングシグナル及び/またはER輸送シグナルを含む。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用に好適であるトラフィックイング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
などのアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含む。ある場合には、ER輸送シグナルは、例えば、
等である。
C1C2キメラカチオンチャネル
他の実施形態において、光反応性カチオンチャネルタンパク質は、コナミドリムシからのChR1及びChR2タンパク質に由来するC1C2キメラタンパク質であり、このタンパク質は、光に反応性であり、細胞が光によって照射されるとき、細胞中の電流を脱分極することを仲介できる。別の実施形態において、この光反応性ポリペプチドは、SEQ ID NO:12に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。この光反応性カチオンチャネルタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/または光反応性カチオンチャネルタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、光反応性カチオンチャネルタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有する光反応性プロトンポンプタンパク質は、細胞膜を横切ってカチオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、C1C2タンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上など)のアミノ酸配列モチーフを含む。いくつかの実施形態において、C1C2タンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、C1C2タンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C1C2タンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C1C2タンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、C1C2タンパク質は、SEQ ID NO:13に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
ReaChR
いくつかの態様において、脱分極性光反応性ポリペプチドは、コナミドリムシに由来する脱分極性光反応性ポリペプチドの赤色シフト(red shifted)変異体であり、このような光反応性ポリペプチドは、本明細書において「ReaChRポリペプチド」または「ReaChRタンパク質」もしくは「ReaChR」と称される。別の実施形態において、この光反応性ポリペプチドは、SEQ ID NO:14に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。ReaChRポリペプチドを活性化するために使用される光は、約590nm〜約630nmの波長を有することができるか、または約610nmの波長を有することができる。ReaChRタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/または光反応性カチオンチャネルタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、ReaChRタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するReaChRは、細胞膜を横切ってカチオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、ReaChRタンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上など)のアミノ酸配列モチーフを含む。いくつかの実施形態において、ReaChRタンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、ReaChRタンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、ReaChRタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、ReaChRタンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、ReaChRタンパク質は、SEQ ID NO:15に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
SdChR
いくつかの態様において、脱分極性光反応性ポリペプチドは、シェルフェリア・デュビア(Scherffelia dubia)に由来するSdChRポリペプチドであり、SdChRポリペプチドは、細胞が光によって照射されるとき、細胞膜を横切ってカチオンを輸送することができる。ある場合には、SdChRポリペプチドは、SEQ ID NO:16に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。SdChRポリペプチドを活性化するために使用される光は、約440nm〜約490nmの波長を有することができるか、または約460nmの波長を有することができる。SdChRタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはSdChRタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。場合によっては、SdChRタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するSdChRタンパク質は、細胞膜を横切ってカチオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、SdChRタンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上など)のアミノ酸配列モチーフを含む。いくつかの実施形態において、SdChRタンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、SdChRタンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、SdChRタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、SdChRタンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、SdChRタンパク質は、SEQ ID NO:17に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
CnChR1
いくつかの態様において、脱分極性光反応性ポリペプチドは、例えば、クラミドモナス・ノクチガマ(Chlamydomonas noctigama)に由来するCnChR1ポリペプチドとすることができ、CnChR1ポリペプチドは、細胞が光によって照射されるとき、細胞膜を横切ってカチオンを輸送することができる。ある場合には、CnChR1ポリペプチドは、SEQ ID NO:18に示される配列に少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。CnChR1ポリペプチドを活性化するために使用される光は、約560nm〜約630nmの波長を有することができるか、または約600nmの波長を有することができる。CnChR1タンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはCnChR1タンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。ある場合には、CnChR1タンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するCnChR1タンパク質は、細胞膜を横切ってカチオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、CnChR1タンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上など)のアミノ酸配列モチーフを含む。いくつかの実施形態において、CnChR1タンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、CnChR1タンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、CnChR1タンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、CnChR1タンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、CnChR1タンパク質は、SEQ ID NO:19に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
Csクリムソン(CsChrimson)
いくつかの態様において、脱分極性光反応性カチオンチャネルタンパク質は、クロロモナス・スブジビザ(Chloromonas subdivisa)のCsChRタンパク質及びクラミドモナス・ノクチガマからのCnChR1タンパク質に由来するCsクリムソンキメラタンパク質であり、このタンパク質のN末端は、CsChRの残基1〜73のアミノ酸配列それに続くCnChR1のアミノ酸配列の残基79〜350を含み、脱分極性光反応性カチオンチャネルタンパク質は、光と反応性であり、細胞が光によって照射されるとき、細胞中の電流を脱分極することを仲介できる。別の実施形態において、Csクリムソンポリペプチドは、SEQ ID NO:20に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。Csクリムソンタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはCsクリムソンタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、Csクリムソンタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するCsクリムソンタンパク質は、細胞膜を横切ってカチオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、Csクリムソンタンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上など)のアミノ酸配列モチーフを含む。いくつかの実施形態において、Csクリムソンタンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、Csクリムソンタンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、Csクリムソンタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、Csクリムソンタンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、Csクリムソンタンパク質は、SEQ ID NO:21に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
ShChR1
いくつかの態様において、脱分極性光反応性ポリペプチドは、例えば、スチゲオクロニウム・ヘルベチクム(Stigeoclonium helveticum)に由来するShChR1ポリペプチドとすることができ、ShChR1ポリペプチドは、細胞が光によって照射されるとき、細胞膜を横切ってカチオンを輸送することができる。ある場合には、ShChR1ポリペプチドは、SEQ ID NO:22に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。Stigeoclonium helveticumに由来するShChR1タンパク質を活性化するために使用される光は、約480nm〜約510nmの波長を有することができるか、または約500nmの波長を有することができる。ShChR1タンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはShChR1タンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、ShChR1タンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するShChR1タンパク質は、細胞膜を横切ってカチオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、ShChR1タンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上など)のアミノ酸配列モチーフを含む。いくつかの実施形態において、ShChR1タンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、ShChR1タンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、ShChR1タンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、ShChR1タンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、ShChR1タンパク質は、SEQ ID NO:23に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
他の好適な脱分極性光反応性ポリペプチドは、例えば、Klapoetke et al.,Nat Methods 2014 11:338に記載されている。
過分極性光反応性ポリペプチド
Arch
いくつかの実施形態において、好適な光反応性ポリペプチドは、アーケロドプシン(Archaerhodopsin)(Arch)プロトンポンプ(例えば、ハロルブルム・ソドメンス(Halorubrum sodomense)に由来するプロトンポンプ)であり、これは、細胞が光によって照射されるとき、細胞の形質膜を横切って1つ以上のプロトンを輸送することができる。この光は、約530〜約595nmの波長を有することができるか、または約560nmの波長を有することができる。いくつかの実施形態において、Archタンパク質は、SEQ ID NO:24に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。Archタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはArchタンパク質の標的細胞の形質膜を横切ってイオンを輸送するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、Archタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するArchタンパク質は、光に反応して標的細胞の形質膜を横切ってイオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、Archタンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルから選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つ(1つ、2つ、3つ、またはそれ以上など)のアミノ酸配列モチーフを含む。いくつかの実施形態において、Archタンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、Archタンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、Archタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、Archタンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、Archタンパク質は、SEQ ID NO:25に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
ArchT
いくつかの実施形態において、好適な光活性化タンパク質は、アーケロドプシン(ArchT)プロトンポンプ(例えば、ハロルブルム属(Halorubrum)TP009に由来するプロトンポンプ)であり、これは、細胞が光によって照射されるとき、細胞の形質膜を横切って1つ以上のプロトンを輸送することができる。この光は、約530〜約595nmの波長を有することができるか、または約560nmの波長を有することができる。いくつかの実施形態において、ArchTタンパク質は、SEQ ID NO:26(ArchT)に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。ArchTタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはArchTタンパク質の標的細胞の形質膜を横切ってイオンを輸送するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、ArchTタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するArchTタンパク質は、光に反応して標的細胞の形質膜を横切ってイオンを輸送するための能力を適切に保持する。
ある場合には、ArchTポリペプチドは、膜トラフィッキングシグナル及び/またはER輸送シグナルを含む。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、ArchTタンパク質は、SEQ ID NO:27に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
GtR3
いくつかの実施形態において、光反応性ポリペプチドは、青色光に反応性であり、グィラルディア・セータ(Guillardia theta)に由来するプロトンポンプタンパク質であり、このプロトンポンプタンパク質は、細胞が青色光によって照射されるとき、細胞中の電流を過分極することを仲介でき、このようなタンパク質は、本明細書では、「GtR3タンパク質」または「GtR3ポリペプチド」と称される。この光は、約450〜約495nmの波長を有することができるか、または約490nmの波長を有することができる。いくつかの実施形態において、GtR3タンパク質は、SEQ ID NO:28(GtR3)に示される配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。GtR3タンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはGtR3タンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、GtR3タンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するGtR3タンパク質は、光に反応して神経細胞の形質膜を過分極するための能力を適切に保持する。
ある場合には、GtR3タンパク質は、SEQ ID NO:28に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のコアアミノ酸配列と、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、哺乳動物細胞の形質膜への輸送を向上させる、少なくとも1つ(1つ、2つ、3つ、またはそれ以上)のアミノ酸配列モチーフとを含む。いくつかの実施形態において、GtR3タンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、GtR3タンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、この光反応性プロトンポンプタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、GtR3タンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、シグナルペプチドは、アミノ酸配列
を含む。いくつかの実施形態において、最初の19個のアミノ酸は、
で置き換えられている。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。GtR3タンパク質は、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、GtR3タンパク質は、SEQ ID NO:29に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
Oxy
いくつかの実施形態において、光活性化タンパク質は、細胞が光によって照射されるとき、1つ以上のプロトンを細胞の形質膜を横切って輸送することができるオキシルリス・マリーナ(Oxyrrhis marina)(Oxy)タンパク質である。この光は、約500〜約560nmの波長を有することができるか、または約530nmの波長を有することができる。いくつかの実施形態において、Oxyタンパク質は、SEQ ID NO:30に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。Oxyタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはOxyタンパク質の標的細胞の形質膜を横切ってイオンを輸送するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、Oxyタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するOxyタンパク質は、光に反応して標的細胞の形質膜を横切ってイオンを輸送するための能力を適切に保持する。
いくつかの実施形態において、Oxyタンパク質は、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、標的細胞の形質膜への輸送を向上させる少なくとも1つの(1つ、2つ、3つ、またはそれ以上の)アミノ酸配列モチーフを含む。いくつかの実施形態において、Oxyタンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、Oxyタンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、Oxyタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、Oxyタンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。Oxyタンパク質は、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
いくつかの実施形態において、Oxyポリペプチドは、膜トラフィッキングシグナル及び/またはER輸送シグナルを含む。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、Oxyタンパク質は、SEQ ID NO:31に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
Mac
いくつかの実施形態において、光反応性プロトンポンプタンパク質(本明細書では「Macタンパク質」と称される)は、光に反応性であり、レプトスフェリア・マクランス(Leptosphaeria maculans)に由来し、このMacタンパク質は、細胞が520nm〜560nmの照射されるとき、細胞の膜を横切ってプロトンを能動輸送することができる。この光は、約520nm〜約560nmの波長を有することができる。いくつかの実施形態において、Macタンパク質は、SEQ ID NO:32またはSEQ ID NO:33(Mac;Mac 3.0)に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。Macタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはMacタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、Macタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するMacタンパク質は、光に反応して神経細胞の形質膜を横切ってプロトンを能動輸送するための能力を適切に保持する。
他の態様において、Macタンパク質は、SEQ ID NO:32に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のコアアミノ酸配列と、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される、哺乳動物細胞の形質膜への輸送を向上させる、少なくとも1つ(1つ、2つ、3つ、またはそれ以上)のアミノ酸配列モチーフとを含む。いくつかの実施形態において、Macタンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、Macタンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、Macタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、Macタンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。Macタンパク質は、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
ある場合には、Macポリペプチドは、膜トラフィッキングシグナル及び/またはER輸送シグナルを含む。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
光活性化プロトンポンプタンパク質に関するさらなる開示は、国際特許出願番号PCT/US2011/028893で見出すことができ、この開示は、その全体が参考として本明細書に組み込まれる。
NpHR
ある場合には、好適な光反応性塩化物ポンプタンパク質は、ナトロモナス・ファラオニス(Natronomonas pharaonis)に由来し、このようなタンパク質は、本明細書において「NpHRタンパク質」または「NpHRポリペプチド」と称される。いくつかの実施形態において、NpHRタンパク質は、濃黄色の光ならびに赤色光と反応性であることができ、NpHRが濃黄色または赤色光によって照射されるとき、ニューロン中の電流を過分極することを仲介できる。NpHRタンパク質を活性化することができる光の波長は、約580〜630nmとすることができる。いくつかの実施形態において、この光は、約589nmの波長であることができるか、またはこの光は、約630nm超(例えば、約740nm未満)の波長を有することができる。別の実施形態において、この光は、630nm周辺の波長を有することができる。いくつかの実施形態において、NpHRタンパク質は、光の連続パルスに露光されたとき、神経膜を少なくとも約90分間にわたって過分極することができる。いくつかの実施形態において、NpHRタンパク質は、SEQ ID NO:34に示される配列と少なくとも約75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。さらに、NpHRタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはNpHRタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。いくつかの実施形態において、NpHRタンパク質は、1つ以上の保存的アミノ酸置換を含む。いくつかの実施形態において、NpHRタンパク質は、1つ以上の非保存的アミノ酸置換を含む。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するNpHRタンパク質は、光に反応して神経細胞の形質膜を過分極するための能力を適切に保持する。
ある場合には、NpHRタンパク質は、SEQ ID NO:34に示される配列と少なくとも約75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のコアアミノ酸配列と、小胞体(ER)輸送シグナルとを含む。このER輸送シグナルは、コアアミノ酸配列のC末端に融合することができるか、またはコアアミノ酸配列のN末端に融合することができる。いくつかの実施形態において、ER輸送シグナルは、リンカーによってコアアミノ酸配列に連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、アミノ酸配列FXYENE(SEQ ID NO:60)を含み、式中Xは、任意のアミノ酸とすることができる。別の実施形態において、ER輸送シグナルは、アミノ酸配列VXXSLを含み、式中Xは、任意のアミノ酸とすることができる。いくつかの実施形態において、ER輸送シグナルは、FCYENEV(SEQ ID NO:61)を含む。
使用するために好適である小胞体(ER)輸送配列としては、例えば
等が挙げられる。ER輸送配列は、約5個のアミノ酸〜約25個のアミノ酸、例えば、約5個のアミノ酸〜約10個のアミノ酸、約10個のアミノ酸〜約15個のアミノ酸、約15個のアミノ酸〜約20個のアミノ酸、または約20個のアミノ酸〜約25個のアミノ酸の長さを有することができる。
他の態様において、NpHRタンパク質は、SEQ ID NO:34に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のコアアミノ酸配列と、(例えば、形質膜への輸送を向上させることができる)トラフィッキングシグナルとを含む。このトラフィッキングシグナルは、コアアミノ酸配列のC末端に融合することができるか、またはコアアミノ酸配列のN末端に融合することができる。いくつかの実施形態において、トラフィッキングシグナルは、リンカーによってコアアミノ酸配列に連結されており、このリンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。NpHRタンパク質は、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来することができる。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含む。
いくつかの態様において、NpHRタンパク質は、SEQ ID NO:34に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のコアアミノ酸配列と、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される選択される、哺乳動物細胞の形質膜への輸送を向上させる少なくとも1つの(1つ、2つ、3つ、またはそれ以上の)アミノ酸配列モチーフを含む。いくつかの実施形態において、NpHRタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。このリンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。NpHRタンパク質は、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含むことができる。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。他の実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。いくつかの実施形態において、シグナルペプチドは、アミノ酸配列
を含む。別の実施形態において、NpHRタンパク質は、SEQ ID NO:35と少なくとも95%同一のアミノ酸配列を含む。別の実施形態において、NpHRタンパク質は、SEQ ID NO:36と少なくとも95%同一のアミノ酸配列を含む。
さらに、他の態様において、NpHRタンパク質は、SEQ ID NO:34に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のコアアミノ酸配列を含み、SEQ ID NO:34のN末端シグナルペプチドは、欠失または置換されている。いくつかの実施形態において、他のシグナルペプチド(他のオプシンからのシグナルペプチドなど)を使用することができる。この光反応性タンパク質は、本明細書に記載されるER輸送シグナル及び/または膜トラフィッキングシグナルをさらに含むことができる。
いくつかの実施形態において、光反応性タンパク質は、SEQ ID NO:34に示される配列と少なくとも75%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、または100%同一のアミノ酸配列を含むNpHRタンパク質である。いくつかの実施形態において、NpHRタンパク質は、小胞体(ER)輸送シグナル及び/または膜トラフィッキングシグナルをさらに含む。例えば、NpHRタンパク質は、SEQ ID NO:34に示される配列と少なくとも95%同一のアミノ酸配列と、小胞体(ER)輸送シグナルとを含む。いくつかの実施形態において、SEQ ID NO:34に示される配列と少なくとも95%同一のアミノ酸配列は、リンカーを通してER輸送シグナルに連結されている。いくつかの実施形態において、ER輸送シグナルは、アミノ酸配列FXYENE(SEQ ID NO:60)を含み、式中Xは、任意のアミノ酸とすることができる。別の実施形態において、ER輸送シグナルは、アミノ酸配列VXXSLを含み、式中Xは、任意のアミノ酸とすることができる。いくつかの実施形態において、ER輸送シグナルは、FCYENEV(SEQ ID NO:61)を含む。いくつかの実施形態において、NpHRタンパク質は、SEQ ID NO:34に示される配列と少なくとも95%同一のアミノ酸配列と、ER輸送シグナルと、膜トラフィッキングシグナルとを含む。他の実施形態において、NpHRタンパク質は、N末端からC末端に向かって、SEQ ID NO:34に示される配列と少なくとも95%同一のアミノ酸配列、ER輸送シグナル、及び膜トラフィッキングシグナルを含む。他の実施形態において、NpHRタンパク質は、N末端からC末端に向かって、SEQ ID NO:34に示される配列と少なくとも95%同一のアミノ酸配列、膜トラフィッキングシグナル、及びER輸送シグナルを含む。いくつかの実施形態において、膜トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。いくつかの実施形態において、膜トラフィッキングシグナルは、アミノ酸配列
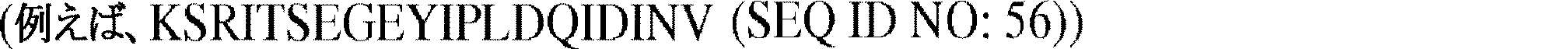
を含む。いくつかの実施形態において、膜トラフィッキングシグナルは、リンカーによってSEQ ID NO:34に示される配列と少なくとも95%同一のアミノ酸配列に連結されている。いくつかの実施形態において、膜トラフィッキングシグナルは、リンカーを通してER輸送シグナルに連結されている。このリンカーは、5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかとすることができる。このリンカーは、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、光反応性タンパク質は、N末端のシグナルペプチドをさらに含む。
光反応性塩化物ポンプタンパク質に関するさらなる開示は、米国特許出願公開第2009/0093403号及び同第2010/0145418号ならびに国際特許出願番号PCT/US2011/028893で見出すことができ、これらのそれぞれの開示は、その全体が参考として本明細書に組み込まれる。
ドナリエラ・サリーナ(Dunaliella Salina)光反応性ポリペプチド
いくつかの実施形態において、好適な光反応性イオンチャネルタンパク質は、例えば、ドナリエラ・サリーナに由来するDsChRタンパク質であり、このイオンチャネルタンパク質は、細胞が光によって照射されるとき、細胞中の電流を過分極することを仲介できる。この光は、約470nm〜約510nmの波長を有することができるか、または約490nmの波長を有することができる。いくつかの実施形態において、DsChRタンパク質は、SEQ ID NO:37に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のアミノ酸配列を含む。さらに、DsChRタンパク質は、光感応性を増加もしくは減少させるために、光の特定の波長に対する感応性を増加もしくは減少させるために、及び/またはDsChRタンパク質の細胞の形質膜の分極状態を調節するための能力を増加もしくは減少させるために、天然アミノ酸配列に導入された置換、欠失、及び/または挿入をさらに含むことができる。さらに、DsChRタンパク質は、1つ以上の保存的アミノ酸置換及び/または1つ以上の非保存的アミノ酸置換を含むことができる。天然アミノ酸配列に導入された置換、欠失、及び/または挿入を含有するDsChRタンパク質は、光に反応して神経細胞の形質膜を横切ってイオンを輸送するための能力を適切に保持する。
ある場合には、DsChRタンパク質は、SEQ ID NO:37に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一のコアアミノ酸配列と、シグナルペプチド、ER輸送シグナル、及び膜トラフィッキングシグナルからなる群から選択される選択される、哺乳動物細胞の形質膜への輸送を向上させる少なくとも1つの(1つ、2つ、3つ、またはそれ以上の)アミノ酸配列モチーフを含む。いくつかの実施形態において、DsChRタンパク質は、N末端のシグナルペプチド及びC末端のER輸送シグナルを含む。いくつかの実施形態において、DsChRタンパク質は、N末端のシグナルペプチド及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、DsChRタンパク質は、N末端のシグナルペプチド、C末端のER輸送シグナル、及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、DsChRタンパク質は、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルを含む。いくつかの実施形態において、C末端のER輸送シグナル及びC末端のトラフィッキングシグナルは、リンカーによって連結されている。リンカーは、約5、10、20、30、40、50、75、100、125、150、175、200、225、250、275、300、400、または500個のアミノ酸の長さのうちのいずれかを含むことができる。DsChRタンパク質は、蛍光タンパク質、例えば、限定されるものではないが、黄色蛍光タンパク質、赤色蛍光タンパク質、緑色蛍光タンパク質、またはシアン蛍光タンパク質をさらに含んでもよい。いくつかの実施形態において、ER輸送シグナルは、トラフィッキングシグナルよりも一層C末端側に位置する。いくつかの実施形態において、トラフィッキングシグナルは、ER輸送シグナルよりも一層C末端側に位置する。
ある場合には、DsChRポリペプチドは、膜トラフィッキングシグナル及び/またはER輸送シグナルを含む。いくつかの実施形態において、トラフィッキングシグナルは、ヒト内向き整流カリウムチャネルKir2.1のアミノ酸配列に由来する。他の実施形態において、トラフィッキングシグナルは、アミノ酸配列
を含むことができる。使用するために好適であるトラフィッキング配列は、ヒト内向き整流カリウムチャネルKir2.1のトラフィッキング配列
のようなアミノ酸配列と少なくとも85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含むことができる。ある場合には、ER輸送シグナルは、例えば
等である。
ある特定の実施形態において、DsChRタンパク質は、SEQ ID NO:38に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
C1C2に基づくアニオンチャネルポリペプチド
いくつかの実施形態において、光反応性アニオンチャネルポリペプチドは、C1C2タンパク質である。いくつかの実施形態において、C1C2ポリペプチドは、SEQ ID NO:12に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含む。いくつかの実施形態において、C1C2タンパク質のアミノ酸配列は、以下の突然変異:T98S、E129S、E140S、E162S、V156K、H173R、T285N、V281K及び/またはN297Qのうちの1つ以上をアミノ酸配列に導入することによって修飾される。いくつかの実施形態において、C1C2タンパク質は、上記に列挙したアミノ酸置換のうちの9個全てを有するC1C2のアミノ酸配列を含み、これにより、C1C2ポリペプチドのアミノ酸配列は、SEQ ID NO:39に記載されるものとなる。
いくつかの実施形態において、C1C2ポリペプチドは、SEQ ID NO:39に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またC1C2のアミノ酸配列(SEQ ID NO:12)に対して、T98S、E129S、E140S、E162S、V156K、H173R、T285N、V281K及び/またはN297Qから選択される1、2、3、4、5、6、7、8、または9個のアミノ酸置換を含む。いくつかの実施形態において、C1C2ポリペプチドは、SEQ ID NO:39に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またC1C2のアミノ酸配列に対して、T98S、E129S、E140S、E162S、及びT285N置換を含む。いくつかの実施形態において、C1C2ポリペプチドは、SEQ ID NO:39に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またC1C2のアミノ酸配列に対して、V156K、H173R、V281K、及びN297Q置換を含む。
いくつかの実施形態において、C1C2ポリペプチドは、SEQ ID NO:39に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297の1、2、3、4、5、6、7、8、または9個を含み、このアミノ酸番号付けは、SEQ ID NO:39に記載される通りである。いくつかの実施形態において、C1C2ポリペプチドは、SEQ ID NO:39に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297を含み、このアミノ酸番号付けは、SEQ ID NO:39に記載される通りである。これらの実施形態のいずれか1つにおいて、C1C2ポリペプチドは、膜トラフィッキングシグナル
を含むことができる。これらの実施形態のいずれか1つにおいて、C1C2ポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含むことができる。これらの実施形態のいずれか1つにおいて、C1C2ポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含むことができる。したがって、C1C2タンパク質は、SEQ ID NO:40に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
いくつかの実施形態において、C1C2ポリペプチドは、タンパク質C1C2のアミノ酸配列(SEQ ID NO:12)に基づいており、このアミノ酸配列は、C1C2の最初の50個のN末端アミノ酸が、タンパク質ChR2からのアミノ酸1〜11
で置き換えることによって修飾されている。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、「ibC1C2」と称され、SEQ ID NO:43に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、このアミノ酸番号付けは、SEQ ID NO:43に記載される通りである。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、SEQ ID NO:43に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、このアミノ酸番号付けは、SEQ ID NO:43に記載される通りである。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、SEQ ID NO:43に記載されるアミノ酸配列を含む。これらの実施形態のいずれか1つにおいて、好適な光反応性アニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含むことができる。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含むことができる。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含むことができる。したがって、ibC1C2タンパク質は、SEQ ID NO:44に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、タンパク質C1C2のアミノ酸配列(SEQ ID NO:12)に基づいており、167位のシステインアミノ酸残基が、スレオニン残基で置き換えられている。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチド、例えばSwiChR
CTは、SEQ ID NO:41に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297の1、2、3、4、5、6、7、8、または9個を含み、かつT167を含む。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、SEQ ID NO:41に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297を含み、かつT167を含み、このアミノ酸番号付けは、SEQ ID NO:41に記載される通りである。いくつかの実施形態において、光反応性アニオンチャネルポリペプチドは、SEQ ID NO:5に提供されるアミノ酸配列を含む。これらの実施形態のいくつかにおいて、この光反応性ポリペプチドは、光電流の長期安定性を示す。いくつかの実施形態において、最初の50個のアミノ酸は、
で置き換えられている。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
の両方を含む。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、タンパク質C1C2のアミノ酸配列に基づいており、167位のシステインアミノ酸残基が、アラニン残基で置き換えられている。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチド、例えばSwiChR
CAは、SEQ ID NO:41に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297の1、2、3、4、5、6、7、8、または9個を含み、かつA167を含み、このアミノ酸番号付けは、SEQ ID NO:41に記載される通りである。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、SEQ ID NO:41に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297を含み、かつA167を含み、このアミノ酸番号付けは、SEQ ID NO:41に記載される通りである。いくつかの実施形態において、最初の50個のアミノ酸は、
で置き換えられている。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、タンパク質C1C2のアミノ酸配列に基づいており、167位のシステインアミノ酸残基が、セリン残基で置き換えられている。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチド、例えばSwiChR
CSは、SEQ ID NO:41に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297の1、2、3、4、5、6、7、8、または9個を含み、かつS167を含み、このアミノ酸番号付けは、SEQ ID NO:41に記載される通りである。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、SEQ ID NO:41に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297を含み、かつS167を含み、このアミノ酸番号付けは、SEQ ID NO:41に記載される通りである。いくつかの実施形態において、最初の50個のアミノ酸は、
で置き換えられている。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
ある特定の実施形態において、SwiChRタンパク質は、SEQ ID NO:42に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチド、SwiChRは、SEQ ID NO:41に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297の1、2、3、4、5、6、7、8、または9個を含み、N195、またはA195を含み、またA167を含み、このアミノ酸番号付けは、SEQ ID NO:41に記載される通りである。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、SEQ ID NO:41に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297を含み、A167を含み、またN195、またはA195を含み、このアミノ酸番号付けは、SEQ ID NO:41に記載される通りである。いくつかの実施形態において、最初の50個のアミノ酸は、MDYGGALSAVG(SEQ ID NO:55)で置き換えられている。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、上述した修飾のうちの1つ以上を有するタンパク質C1C2のアミノ酸配列に基づいており、元の195位のアスパラギン酸アミノ酸残基が、アラニン残基で置き換えられている。このタンパク質の最初の50個のN末端アミノ酸が、タンパク質ChR2からのアミノ酸1〜11によって置き換えられているある特定の実施形態において、156位のアスパラギン酸アミノ酸(これは、SEQ ID NO:12に記載されるC1C2アミノ酸配列の元の195位に相当する)は、アラニン残基によって置き換えられている。
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、上述した修飾のうちの1つ以上を有するタンパク質C1C2のアミノ酸配列に基づいており、元の195位のアスパラギン酸アミノ酸残基が、アスパラギン残基で置き換えられている。このタンパク質の最初の50個のN末端アミノ酸が、タンパク質ChR2からのアミノ酸1〜11によって置き換えられているある特定の実施形態において、156位のアスパラギン酸アミノ酸(これは、SEQ ID NO:12に記載されるC1C2アミノ酸配列の元の195位に相当する)は、アスパラギン残基によって置き換えられている。
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:43に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、またA128、T128またはS128を含み、このアミノ酸番号付けは、SEQ ID NO:43に記載される通りである。いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:43に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、またA128、T128またはS128を含み、このアミノ酸番号付けは、SEQ ID NO:43に記載される通りである。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
ChR2に基づくアニオンチャネルタンパク質
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、タンパク質ChR2のアミノ酸配列に基づく。ChR2のアミノ酸配列は、SEQ ID NO:4に記載されている。いくつかの実施形態において、ChR2タンパク質のアミノ酸配列は、以下の突然変異:A59S、E90S、E101S、E123S、Q117K、H134R、V242K、T246N、及び/またはN258Qのうちの1つ以上をアミノ酸配列に導入することによって修飾されている。いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、上で列記したアミノ酸置換の全ての9個を有するタンパク質ChR2のアミノ酸配列を含み、これにより、このポリペプチドのアミノ酸配列は、SEQ ID NO:45(iChR2)に提供されている。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドiChR2は、SEQ ID NO:45に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またChR2のアミノ酸配列(SEQ ID NO:4)に対して、A59S、E90S、E101S、E123S、Q117K、H134R、V242K、T246N、及び/またはN258Qから選択される1、2、3、4、5、6、7、8、または9個のアミノ酸置換を含む。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチド(「iChR2」)は、SEQ ID NO:45に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、K242、N246及びQ258の1、2、3、4、5、6、7、8、または9個を含み、このアミノ酸番号付けは、SEQ ID NO:45に記載される通りである。いくつかの実施形態において、iChR2ポリペプチドは、SEQ ID NO:45に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、K242、N246及びQ258の1、2、3、4、5、6、7、8、9、10、または11個を含み、またN156またはA156のいずれかを含み、またT128、A128、またはS128のいずれかを含み、このアミノ酸番号付けは、SEQ ID NO:45に記載される通りである。いくつかの実施形態において、iChR2ポリペプチドは、SEQ ID NO:45に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、K242、N246、及びQ258を含み、このアミノ酸番号付けは、SEQ ID NO:45に記載される通りである。これらの実施形態のいずれか1つにおいて、iChR2ポリペプチドは、膜トラフィッキングシグナル
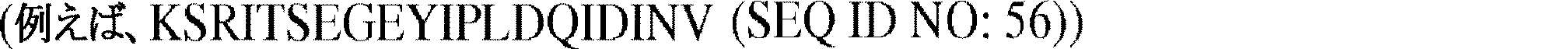
を含むことができる。これらの実施形態のいずれか1つにおいて、iChR2ポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含むことができる。これらの実施形態のいずれか1つにおいて、iChR2ポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含むことができる。したがって、ある特定の実施形態において、iChR2タンパク質は、SEQ ID NO:46に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
C1V1に基づくアニオンチャネルポリペプチド
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、タンパク質C1V1のアミノ酸配列に基づく。C1V1のアミノ酸配列は、SEQ ID NO:10に記載されている。いくつかの実施形態において、C1V1タンパク質のアミノ酸配列は、以下の突然変異:T98S、E129S、E140S、E162S、V156K、H173R、A285N、P281K及び/またはN297Qのうちの1つ以上をアミノ酸配列に導入することによって修飾される。いくつかの実施形態において、過分極光反応性ポリペプチドは、上記に列挙したアミノ酸置換のうちの9個全てを有するタンパク質C1V1のアミノ酸配列を含み、これにより、このポリペプチドのアミノ酸配列は、SEQ ID NO:47に提供されるものとなる。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチド、iC1V1は、SEQ ID NO:47に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またC1V2のアミノ酸配列(SEQ ID NO:10)に対して、T98S、E129S、E140S、E162S、V156K、H173R、A285N、P281K及び/またはN297Qから選択される1、2、3、4、5、6、7、8、または9個のアミノ酸置換を含む。
いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチド、iC1V1は、SEQ ID NO:47に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297の1、2、3、4、5、6、7、8、または9個を含み、このアミノ酸番号付けは、SEQ ID NO:47に記載される通りである。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチド(「iC1V1」と称される)は、SEQ ID NO:47に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297の1、2、3、4、5、6、7、8、または9個を含み、またN195を含み、このアミノ酸番号付けは、SEQ ID NO:47に記載される通りである。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、SEQ ID NO:47に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297を含み、このアミノ酸番号付けは、SEQ ID NO:47に記載される通りである。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
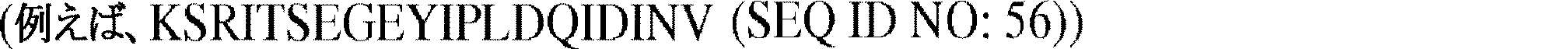
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。したがって、ある特定の実施形態において、iC1V1タンパク質は、SEQ ID NO:48に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、タンパク質C1V1のアミノ酸配列(SEQ ID NO:10)に基づいており、このアミノ酸配列は、C1V1の最初の50個のN末端アミノ酸が、タンパク質ChR2からのアミノ酸1〜11
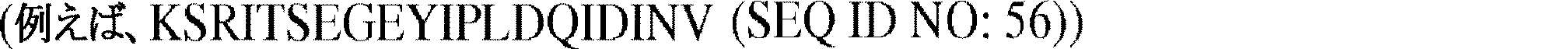
で置き換えることによって修飾されている。いくつかの実施形態において、好適な過分極光反応性アニオンチャネルポリペプチド、ibC1V1は、SEQ ID NO:49に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、このアミノ酸番号付けは、SEQ ID NO:49に記載される通りである。いくつかの実施形態において、好適な過分極光反応性ポリペプチド(「ibC1V1」と称される)は、SEQ ID NO:49に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、またN156を含み、このアミノ酸番号付けは、SEQ ID NO:49に記載される通りである。いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:49に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、このアミノ酸番号付けは、SEQ ID NO:49に記載される通りである。いくつかの実施形態において、好適な光反応性アニオンチャネルポリペプチドは、SEQ ID NO:49に記載されるアミノ酸配列を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
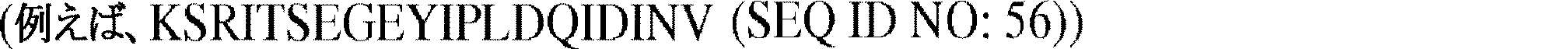
を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含むことができる。したがって、ibC1V1タンパク質は、SEQ ID NO:50に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、タンパク質C1V1のアミノ酸配列(SEQ ID NO:10)に基づいており、167位のシステインアミノ酸残基が、スレオニン残基で置き換えられている。いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:47に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297の1、2、3、4、5、6、7、8、または9個を含み、またT167を含む。いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:47に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297を含み、またT167、S167またはA167を含み、このアミノ酸番号付けは、SEQ ID NO:47に記載される通りである。いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:47に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS98、S129、S140、S162、K156、R173、N285、K281、及びQ297を含み、T167、S167またはA167を含み、またA195またはN195を含み、このアミノ酸番号付けは、SEQ ID NO:47に記載される通りである。いくつかの実施形態において、最初の50個のアミノ酸は、MDYGGALSAVG(SEQ ID NO:55)で置き換えられている。これらの実施形態のいずれか1つにおいて、好適な過分極光反応性ポリペプチドは、膜トラフィッキングシグナル
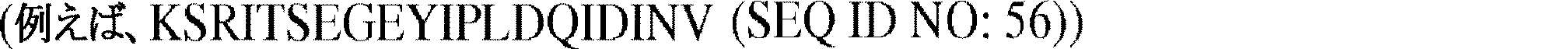
を含む。これらの実施形態のいずれか1つにおいて、好適な過分極光反応性ポリペプチド、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、好適な過分極光反応性ポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、上述された修飾の1つ以上を含むタンパク質C1V1のアミノ酸配列に基づいており、元の195位のアスパラギン酸アミノ酸残基が、アラニン残基で置き換えられている。このタンパク質の最初の50個のN末端アミノ酸がタンパク質ChR2からのアミノ酸1〜11によって置き換えられているある特定の実施形態において、156位のアスパラギン酸アミノ酸(これは、SEQ ID NO:10に記載されるC1V1アミノ酸配列の元の195位に相当する)は、アラニン残基によって置き換えられている。
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、上述された修飾の1つ以上を含むタンパク質C1V1のアミノ酸配列に基づいており、元の195位のアスパラギン酸アミノ酸残基が、アスパラギン残基で置き換えられている。このタンパク質の最初の50個のN末端アミノ酸がタンパク質ChR2からのアミノ酸1〜11によって置き換えられているある特定の実施形態において、156位のアスパラギン酸アミノ酸(これは、SEQ ID NO:10に記載されるC1V1アミノ酸配列の元の195位に相当する)は、アスパラギン残基によって置き換えられている。
いくつかの実施形態において、好適な過分極光反応性ポリペプチド、ibC1V1は、SEQ ID NO:49に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、またT128、A128、またはS128を含み、このアミノ酸番号付けは、SEQ ID NO:49に記載される通りである。いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:49に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、またT128、A128、またはS128を含み、このアミノ酸番号付けは、SEQ ID NO:49に記載される通りである。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、好適なアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:49に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、またT128、A128、またはS128を含み、またA156またはN156を含み、このアミノ酸番号付けは、SEQ ID NO:49に記載される通りである。いくつかの実施形態において、好適な過分極光反応性ポリペプチドは、SEQ ID NO:49に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、またT128、A128、またはS128を含み、またA156またはN156を含み、このアミノ酸番号付けは、SEQ ID NO:49に記載される通りである。これらの実施形態のいずれか1つにおいて、好適な過分極光反応性ポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、好適な過分極光反応性ポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
ReaChRに基づくアニオンチャネルポリペプチド
いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、タンパク質ReaChRのアミノ酸配列に基づく。ReaChRタンパク質のアミノ酸配列は、SEQ ID NO:14に記載されている。いくつかの実施形態において、ReaChRタンパク質のアミノ酸配列は、以下の突然変異:T99S、E130S、E141S、E163S、V157K、H174R、A286N、P282K及び/またはN298Qのうちの1つ以上をアミノ酸配列に導入することによって修飾される。いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、上記に列挙したアミノ酸置換のうちの9個全てを有するタンパク質ReaChRのアミノ酸配列を含み、これにより、このポリペプチドのアミノ酸配列は、SEQ ID NO:51に提供されるものとなる。
いくつかの実施形態において、対象の光反応性アニオンチャネルポリペプチドは、SEQ ID NO:51に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またReaChRのアミノ酸配列(SEQ ID NO:14)に対して、T99S、E130S、E141S、E163S、V157K、H174R、A286N、P282K及び/またはN298Qから選択される1、2、3、4、5、6、7、8、または9個のアミノ酸置換を含む。
いくつかの実施形態において、対象の光反応性アニオンチャネルポリペプチド、iReaChRは、SEQ ID NO:51に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS99、S130、S141、S163、K157、R174、N286、K281、及びQ298の1、2、3、4、5、6、7、8、または9個を含み、このアミノ酸番号付けは、SEQ ID NO:51に記載される通りである。いくつかの実施形態において、対象の光反応性アニオンチャネルポリペプチドは、SEQ ID NO:51に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS99、S130、S141、S163、K157、R174、N286、K281、及びQ298を含み、このアミノ酸番号付けは、SEQ ID NO:51に記載される通りである。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。したがって、ある特定の実施形態において、iReaChRタンパク質は、SEQ ID NO:52に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
いくつかの実施形態において、対象の光反応性アニオンチャネルポリペプチド、iReaChRは、SEQ ID NO:51に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS99、S130、S141、S163、K157、R174、N286、K281、及びQ298の1、2、3、4、5、6、7、8、または9個を含み、またN196を含み、このアミノ酸番号付けは、SEQ ID NO:51に記載される通りである。いくつかの実施形態において、対象の光反応性アニオンチャネルポリペプチドは、SEQ ID NO:51に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS99、S130、S141、S163、K157、R174、N286、K281、及びQ298を含み、またN196を含み、このアミノ酸番号付けは、SEQ ID NO:51に記載される通りである。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、タンパク質ReaChRのアミノ酸配列(SEQ ID NO:14)に基づいており、このアミノ酸配列は、ReaChRの最初の51個のN末端アミノ酸が、タンパク質ChR2からのアミノ酸1〜11
で置き換えることによって修飾されている。いくつかの実施形態において、対象の過分極光反応性アニオンチャネルポリペプチド、ibReaChRは、SEQ ID NO:53に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、このアミノ酸番号付けは、SEQ ID NO:53に記載される通りである。いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、SEQ ID NO:53に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、このアミノ酸番号付けは、SEQ ID NO:53に記載される通りである。いくつかの実施形態において、対象の光反応性アニオンチャネル、SEQ ID NO:53に記載されるアミノ酸配列を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。したがって、ibReaChRタンパク質は、SEQ ID NO:54に示される配列と少なくとも75%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、または100%同一であるアミノ酸配列を含む。
いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、タンパク質ReaChRのアミノ酸配列(SEQ ID NO:14)に基づいており、このアミノ酸配列は、ReaChRの最初の51個のN末端アミノ酸が、タンパク質ChR2からのアミノ酸1〜11
で置き換えることによって修飾されている。いくつかの実施形態において、対象の過分極光反応性アニオンチャネルポリペプチド、SEQ ID NO:53に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、またN156を含み、このアミノ酸番号付けは、SEQ ID NO:53に記載される通りである。いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、SEQ ID NO:53に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、またN156を含み、このアミノ酸番号付けは、SEQ ID NO:53に記載される通りである。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、タンパク質ReaChRのアミノ酸配列(SEQ ID NO:14)に基づいており、168位のシステインアミノ酸残基が、スレオニン残基で置き換えられている。いくつかの実施形態において、対象の過分極光反応性アニオンチャネルポリペプチドは、SEQ ID NO:51に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS99、S130、S141、S163、K157、R174、N286、K281、及びQ298の1、2、3、4、5、6、7、8、または9個を含み、またT168、S168またはA168を含む。いくつかの実施形態において、対象の光反応性アニオンチャネルポリペプチドは、SEQ ID NO:60に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS99、S130、S141、S163、K157、R174、N286、K281、及びQ298を含み、またT168、S168またはA168を含み、このアミノ酸番号付けは、SEQ ID NO:51に記載される通りである。いくつかの実施形態において、最初の51個のアミノ酸は、
で置き換えられている。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、対象の過分極光反応性ポリペプチド、iReaChRは、SEQ ID NO:51に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS99、S130、S141、S163、K157、R174、N286、K281、及びQ298の1、2、3、4、5、6、7、8、または9個を含み、A196またはN196を含み、またT168、S168、またはA168を含み、このアミノ酸番号付けは、SEQ ID NO:51に記載される通りである。いくつかの実施形態において、対象の過分極光反応性アニオンチャネルポリペプチドは、SEQ ID NO:51に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS99、S130、S141、S163、K157、R174、N286、K281、及びQ298を含み、A196またはN196を含み、またT168、S168、またはA168を含み、このアミノ酸番号付けは、SEQ ID NO:51に記載される通りである。いくつかの実施形態において、最初の51個のアミノ酸は、
で置き換えられている。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、上述した修飾の1つ以上を含むタンパク質ReaChRのアミノ酸配列に基づいており、元の196位のアスパラギン酸アミノ酸残基が、アラニン残基で置き換えられている。このタンパク質の最初の51個のN末端アミノ酸がタンパク質ChR2からのアミノ酸1〜11によって置き換えられているある特定の実施形態において、156位のアスパラギン酸アミノ酸(これは、SEQ ID NO:14に記載されるReaChRアミノ酸配列の元の196位に相当する)は、アラニン残基によって置き換えられている。
いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、上述した修飾の1つ以上を含むタンパク質ReaChRのアミノ酸配列に基づいており、元の196位のアスパラギン酸アミノ酸残基が、アスパラギン残基で置き換えられている。このタンパク質の最初の51個のN末端アミノ酸がタンパク質ChR2からのアミノ酸1〜11によって置き換えられているある特定の実施形態において、156位のアスパラギン酸アミノ酸(これは、SEQ ID NO:14に記載されるReaChRアミノ酸配列の元の196位に相当する)は、アスパラギン残基によって置き換えられている。
いくつかの実施形態において、対象の過分極光反応性ポリペプチド、ibReaChRは、SEQ ID NO:53に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、またT128、S128、またはA128を含み、このアミノ酸番号付けは、SEQ ID NO:53に記載される通りである。いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、SEQ ID NO:53に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、またT128を含み、このアミノ酸番号付けは、SEQ ID NO:53に記載される通りである。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
いくつかの実施形態において、対象の過分極光反応性ポリペプチド、ibReaChRは、SEQ ID NO:53に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258の1、2、3、4、5、6、7、8、または9個を含み、またT128、S128、またはA128を含み、またA156またはN156を含み、このアミノ酸番号付けは、SEQ ID NO:53に記載される通りである。いくつかの実施形態において、対象の過分極光反応性ポリペプチドは、SEQ ID NO:53に記載されるアミノ酸配列と少なくとも58%、少なくとも60%、少なくとも65%、少なくとも70%、少なくとも75%、少なくとも80%、少なくとも85%、少なくとも90%、少なくとも95%、少なくとも98%、少なくとも99%、または100%のアミノ酸配列同一性を有するアミノ酸配列を含み、またS59、S90、S101、S123、K117、R134、N246、K242、及びQ258を含み、またT128、S128、またはA128を含み、またA156またはN156を含み、このアミノ酸番号付けは、SEQ ID NO:53に記載される通りである。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、ER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))を含む。これらの実施形態のいずれか1つにおいて、対象のアニオンチャネルポリペプチドは、膜トラフィッキングシグナル
及びER輸送シグナル(例えば、FCYENEV(SEQ ID NO:61))の両方を含む。
発現ベクター
上で述べたように、本開示の態様は、D2SPを含む核酸を含んでいる組換え発現ベクターを含む。好適な発現ベクターとしては、ベクターのポリヌクレオチドから転写されるとき、対象の遺伝子産物の発現をもたらすことになる、RNA(例えば、mRNA)をコードするヌクレオチド配列を含むベクターが含まれる。ある場合には、遺伝子産物はポリペプチドである。ある場合には、発現ベクター中でコードされる遺伝子産物は、標的細胞の形質膜上で発現する光反応性ポリペプチドである。他の例では、発現ベクター中でコードされる遺伝子産物は、標的細胞の細胞質ゾル中で発現する蛍光タンパク質である。使用され得るベクターとしては、限定されるものではないが、レンチウイルス、単純ヘルペスウイルス、アデノウイルス、及びアデノ随伴ウイルス(AAV)ベクターが挙げられる。レンチウイルスベクターとしては、ヒト免疫不全ウイルス(HIV)に基づくベクターが挙げられるが、これらに限定されない。レンチウイルスベクターは、水疱性口内炎ウイルス(VSV)、狂犬病ウイルス、モロニ―マウス白血病ウイルス(MLV)、バキュロウイルス及びエボラウイルスが含まれるがこれらに限定されない他のウイルスのエンベロープタンパク質でシュードタイプ化されてもよい。このようなベクターは、当該技術分野における標準方法を用いて調製することができる。
関心対象の他のベクターとして、プラスミドベクターが含まれる。本明細書で使用されるプラスミドという用語は、核酸、例えば、プラスミドベクター、コスミド、ファージミドまたはバクテリオファージに由来するDNAを指し、その中に特定の遺伝子をコードする核酸の1つ以上の断片が挿入またはクローンされ得る。これは、通常、宿主細胞において染色体DNAから独立して複製することができるDNAの環状二本鎖からなる染色体外遺伝物質から構成された構築物を含む。
ある特定の実施形態において、組換え発現ベクターは、関心対象の遺伝子産物をコードするヌクレオチド配列を組換え発現ベクター中にサブクローニングすることを容易にする複数のクローニングサイトを含み、これによって、関心対象の遺伝子才物をコードするヌクレオチド配列をD2SPに作動可能に連結する。
いくつかの実施形態において、ベクターは、組換えAAVベクターであることができる。AAVベクターは、安定かつ部位特異的方法で、これらが感染する細胞のゲノム中に一体化することができる比較的小型のDNAウイルスである。これらはまた、細胞の増殖、形態または分化にいかなる作用も誘発することなく、広範囲の細胞に感染することが可能であり、これらは人体病理学に関与するとは見なされていない。AAVのゲノムはクローンされ、配列決定され、また特性評価されている。これは、およそ4700個の塩基を包含し、各末端に、ウイルスのための複製起点として機能するおよそ145個の塩基の末端逆位配列(ITR)領域を含む。ゲノムの残部は、キャプシド形成機能を実行する2つの必須領域:ウイルスの複製及びウイルス遺伝子の発現に関与するrep遺伝子を含むゲノムの左側部分、ならびにウイルスのキャプシドタンパク質をコードするcap遺伝子を含むゲノムの右側部分に分割される。
AAVベクターは、当該技術分野における標準方法を用いて調製することができる。任意の血清型のアデノ随伴ウイルスが好適である(例えば、Blacklow,pp.165−174 of“Parvoviruses and Human Disease”J.R.Pattison,ed.(1988);Rose,Comprehensive Virology 3:1,1974;P.Tattersall“The Evolution of Parvovirus Taxonomy”In Parvoviruses(JR Kerr,SF Cotmore.ME Bloom,RM Linden,CR Parrish,Eds.)p5−14,Hudder Arnold,London,UK(2006);及びDE Bowles,JE Rabinowitz,RJ Samulski“The Genus Dependovirus”(JR Kerr,SF Cotmore.ME Bloom,RM Linden,CR Parrish,Eds.)p15−23,Hudder Arnold,London,UK(2006)を参照されたい。これらのそれぞれは、それらの全体が参考として本明細書に組み込まれる)。ベクターを精製するための方法は、例えば、米国特許第6,566,118号、同第6,989,264、及び同第6,995,006号、ならびに“Methods for Generating High Titer Helper−free Preparation of Recombinant AAV Vectors”と題されたWO/1999/011764で見出すことができ、これらの開示は、それらの全体が参考として本明細書に組み込まれる。バキュロウイルス系でAAVベクターを調整する方法が、例えばWO2008/024998に記載されている。AAVベクターは、自己相補性または一本鎖とすることができる。ハイブリッドベクターの調製物が、例えば、PCT出願番号PCT/US2005/027091に記載され、この開示は、その全体が参考として本明細書に組み込まれる。AAVに由来するベクターの遺伝子をインビトロならびにインビボで導入するための使用が記載されている(例えば、国際特許出願公開第91/18088号及びWO 93/09239;米国特許第4,797,368号、同第6,596,535号、及び同第5,139,941号;ならびに欧州特許第0488528号を参照されたい。これらの全ては、それらの全体が参考として本明細書に組み込まれる)。これらの刊行物は、rep及び/またはcap遺伝子が欠失され、関心対象の遺伝子によって置き換えられた様々なAAV由来の構築物、及びこれらの構築物の関心対象の遺伝子をインビトロで(培養細胞中に)またはインビボで(生物に直接)導入するための使用を記載している。本開示による複製欠損の組換えAAVは、2つのAAVの末端逆位配列(ITR)領域に隣接する関心対象の核酸配列を含むプラスミドと、AAVのキャプシド形成遺伝子(rep及びcap遺伝子)を担持するプラスミドとを、ヒトヘルパーウイルス(例えば、アデノウイルス)で感染されている細胞株にコトランスフェクトすることによって調製することができる。生成されるAAV組換え体は、次いで標準技法によって精製される。
いくつかの実施形態において、本開示の方法で使用するためのベクターは、ウイルス粒子(例えば、AAV1、AAV2、AAV3、AAV4、AAV5、AAV6、AAV7、AAV8、AAV9、AAV10、AAV11、AAV12、AAV13、AAV14、AAV15、及びAAV16が挙げられるが、これらに限定されないAAVウイルス粒子)中にキャプシド化される。したがって、本開示は、本明細書に記載されるベクターのいずれかを含む組換えウイルス粒子(これが組換えポリヌクレオチドを含有するために組換え体である)を含む。このような粒子を生成する方法は当該技術分野において既知であり、米国特許第6,596,535号に記載されており、この開示は、その全体が参考として本明細書に組み込まれる。ある場合には、AAV6が用いられる。ある場合には、AAV1が用いられる。
いくつかの実施形態において、対象のD2SPは、D2受容体発現神経集団を標的化するために、様々な光反応性ポリペプチド(LRP)、蛍光タンパク質(XFP)、及び遺伝的にコードされたインジケータ(GEI)をコードするヌクレオチド配列に作動可能に連結され得る。例えば、以下のアデノ随伴ベクター(AAV)及びそれらの構成成分:限定されるものではないが、AAV−D2SP−LRP−XFP、AAV−D2SP−GEI、AAV−D2SP−FLEX−LRP−XFP、AAV−D2SP−FLEX−GEIが使用されてもよい。ポリヌクレオチドと関連付けて使用することができる他のAAVベクターとしては、Cre及びFlpなどのリコンビナーゼの制御下でのタンパク質の発現を可能にするLox配列に挟まれた逆向き挿入(double floxed inverted)リーディングフレーム(DIO)を伴うもの:AAV−2SP−DIO(Cre)−LRP−XFP(Cre依存的発現)、AAV−D2SP−DIO(Flp)−LRP−XFP(Flp依存的発現)、AAV−D2SP−DIO(Cre)−DIO(Flp)−LRP−XFP(Cre及びFlp依存的発現)が挙げられる。
遺伝子改変宿主細胞
本開示は、対象の核酸で遺伝的に改変されている単離された遺伝子改変宿主細胞(例えば、インビトロの細胞)を提供する。いくつかの実施形態において、対象の単離された遺伝子改変宿主細胞は、本開示のD2SPに作動可能に連結されたヌクレオチド配列によってコードされる遺伝子産物を生成することができる。
好適な宿主細胞は、哺乳動物細胞などの真核宿主細胞を含む。関心対象の哺乳動物細胞は、ヒト細胞、ラット細胞及びマウス細胞などの齧歯類細胞を含む。対象核酸の宿主細胞への導入は、例えば、リン酸カルシウム沈殿、DEAEデキストラン仲介トランスフェクション、リポソーム仲介トランスフェクション、電気穿孔法、ウイルス感染、または他の既知の方法によって行うことができる。
好適な哺乳動物細胞は、初代細胞または幹細胞などの前駆細胞を含む。ある場合には、哺乳動物細胞は、ニューロン、例えば、非不死化(一次)ニューロンである。いくつかの実施形態において、細胞は、神経細胞または神経様細胞である。この細胞は、ヒト、非ヒト霊長類、マウス、またはラット起源のもの、もしくはヒト以外の哺乳動物、非ヒト霊長類、ラット、またはマウスから誘導されたものとすることができる。好適な細胞株としては、ヒト神経膠腫細胞株、例えばSVGp12(ATCC CRL−8621)、CCF−STTG1(ATCC CRL−1718)、SW 1088(ATCC HTB−12)、SW 1783(ATCC HTB−13)、LLN−18(ATCC CRL−2610)、LNZTA3WT4(ATCC CRL−11543)、LNZTA3WT11(ATCC CRL−11544)、U−138MG(ATCC HTB−16)、U−87 MG(ATCC HTB−14)、H4(ATCC HTB−148)、及びLN−229(ATCC CRL−2611);ヒト髄芽腫由来細胞株、例えば、D342 Med(ATCC HTB−187)、Daoy(ATCC HTB−186)、D283 Med(ATCC HTB−185);ヒト腫瘍由来神経様細胞、例えば、PFSK−1(ATCC CRL−2060)、SK−N−DZ(ATCCCRL−2149)、SK−N−AS(ATCC CRL−2137)、SK−N−FI(ATCC CRL−2142)、IMR−32(ATCC CCL−127)等;マウス神経細胞株、例えば、BC3H1(ATCC CRL−1443)、EOC1(ATCC CRL−2467)、C8−D30(ATCC CRL−2534)、C8−S(ATCC CRL−2535)、Neuro−2a(ATCC CCL−131)、NB41A3(ATCC CCL−147)、SW10(ATCC CRL−2766)、NG108−15(ATCC HB−12317);ラット神経細胞株、例えば、PC−12(ATCC CRL−1721)、CTX TNA2(ATCC CRL−2006)、C6(ATCC CCL−107)、F98 (ATCC CRL−2397)、RG2(ATCC CRL−2433)、B35(ATCC CRL−2754)、R3(ATCC CRL−2764)、SCP(ATCC CRL−1700)、OA1(ATCC CRL−6538)が挙げられるが、これらに限定されない。
場合によっては、宿主細胞は、前駆細胞または幹細胞である。本明細書で使用される「幹細胞」とは、誘導される際に、多系列の細胞に分化する能力(多分化能性または多能性)及び細胞分裂後にその多分化能性または多能性を維持するための能力(自己複製するための能力)の両方を有する細胞を指す。幹細胞は、例えば、造血幹細胞、神経幹細胞、肝幹細胞、真皮幹細胞、生殖幹細胞、及び胚性幹細胞(ES)または人工多能性幹細胞(iPS)、ならびにこれらの細胞から誘導された幹細胞等を包含する。幹細胞は、胚、出生後、未成体及び成体組織から得ることができる。「前駆細胞」とは、幹細胞に由来する未分化細胞を指し、それ自体は幹細胞ではない。一部の前駆細胞は、複数の細胞型に分化することができる子孫を生み出すことができる。
いくつかの実施形態において、宿主細胞は、ヒトES細胞である。ある特定の実施形態において、ヒトES細胞は、ニューロンに分化することができる。ES細胞の増殖及び分化を誘導するための任意の好適な方法を用いることができ、それらのいくつかは、例えば、米国特許第8,460,931号及び同第7,892,835号;米国出願公開第20130252335号及び同第20100075416号;PCT出願公報番号WO2001/088100;ならびにKawasaki et al.,Neuron 2000 28:31に記載されており、これらは、参考として本明細書に組み込まれる。他の実施形態において、宿主細胞は、iPS細胞であり、これは、例えば、PCT出願公報番号WO2007/069666にさらに詳細に記載されており、これは、参考として本明細書に組み込まれる。
方法
上で概説したように、本開示の態様は、標的細胞に、遺伝子産物に作動可能に連結されたD2SPを含む核酸を導入する方法を含み、この遺伝子産物は、発現したときに、関心対象の機能、例えば、光誘発脱分極/過分極及び/または蛍光標識を実行する。核酸を標的細胞に導入することは、遺伝子改変宿主細胞について上述された任意の簡便な方法によって行うことができる。標的細胞は、インビトロ培養中にあるものでもよく、インビボに位置するもの、例えば、脳内の神経細胞などのインビボの組織中の細胞であってもよい。
ある特定の実施形態において、標的細胞は、神経前駆細胞などの前駆細胞である。場合によっては、標的細胞は、幹細胞である。核酸を前駆細胞または幹細胞中に導入するための任意の簡便な方法を、遺伝子改変された宿主細胞に関して上述された遺伝子産物に作動可能に連結されたD2SPを含む核酸を導入するために使用することができる。
いくつかの実施形態において、標的ニューロンは、例えば感覚ニューロン、運動ニューロン、または介在ニューロンである。本開示の標的ニューロンは、中枢神経系のニューロン及び/または末梢神経系の細胞を含んでもよい。いくつかの実施形態において、標的組織は、複数の神経線維、神経、神経細胞節、神経筋接合部、筋肉、皮膚、または内分泌組織が含まれるが、これらに限定されない神経によって神経支配された組織、もしくは脳または脊髄の一部もしくは一部分(sub−portion)などの解剖学的領域を含んでもよい。いくつかの実施形態において、標的組織は、神経細胞(nerve cell)の特定の軸索などの個々の細胞の一部であってもよい。
例示の標的細胞、脳領域及び組織としては、大脳基底核、側坐核、皮質、手綱、腹側被蓋野、黒質、嗅結節、中隔、扁桃体、海馬、小脳、視床、化学受容基引金帯、脳下垂体、視床下部、交感神経節、副腎、末梢求心性神経、腸神経、胃腸粘膜、心臓、肺組織、血管組織、腎皮質ならびに腎臓の髄質内層、及び神経膠芽腫が挙げられるが、これらに限定されない。
D2SPに作動可能に連結された遺伝子産物をコードするヌクレオチド配列を含む核酸は、任意の簡便な手段によって、ニューロンに導入することができる。例えば、D2SPに作動可能に連結された遺伝子産物をコードするヌクレオチド配列を含む核酸は、神経束または神経に導入する(注入する)ことができ、これにより、核酸はニューロンに入り込み、ここでD2SPに作動可能に連結された遺伝子産物がニューロン中で生成される。D2SPに作動可能に連結された遺伝子産物をコードするヌクレオチド配列を含む核酸は、ニューロンに近接して導入する(注入する)ことができる。定位的注入を用いることができ、例えば、Stein et al.,J.Virol,73:34243429,1999;Davidson et al.,PNAS,97:3428−3432,2000;Davidson et al.,Nat.Genet.3:219−223,1993;及びAlisky & Davidson,Hum.Gene Ther.11:2315−2329,2000を参照されたく、これらのそれぞれの内容はそれらの全体が参考として本明細書に組み込まれる。
対象のポリペプチドが標的ニューロンまたは組織に送達されると、ポリヌクレオチドは標的細胞に入り込み、発現する。いくつかの実施形態において、対象の核酸からの発現は、D2SPが活性である標的細胞中のみで起こる。このように、対象のポリペプチドが標的細胞以外の細胞に送達される場合には、このポリペプチドは、D2SPがこれらの細胞中では不活性であるために、非標的細胞中では発現しないであろう。場合によっては、D2SPは、これに作動可能に連結された遺伝子産物の発現を、高い特異度で駆動する。プロモーターの特異度は、プロモーターに作動可能に連結された遺伝子産物を発現し、D2受容体に特異的な抗体(例えば、Millipore ab1558;図3)によって陽性染色される細胞の数を、プロモーターに作動可能に連結された遺伝子産物を発現する細胞の総数で割ったものとして表すことができる。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、91%以上、例えば92%以上、93%以上、94%以上、95%以上、95.5%以上、96%以上、96.5%以上、97%以上、97.5%以上、98%以上、98.1%以上、98.2%以上、98.3%以上、98.4%以上、または98.5%以上の特異度で駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、99%以下、例えば、99.5%以下、99.3%以下、99.1%以下、99.0%以下、98.9%以下、98.8%以下、98.7%以下、98.6%以下、98.5%以下、98.4%以下、98.3%以下、または98.2%の特異度で駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、91〜99%の範囲の、例えば、92〜99%、例えば、93〜99%、94〜98.5%、または95〜98.5%の特異度で駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、約98.2%の特異度で駆動する。
場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、従来のD2受容体プロモーター、例えば、SEQ ID NO:2(図2)に示される配列と少なくとも90%、例えば、少なくとも95%、少なくとも98%、少なくとも99%または100%同一の配列を有する核酸などの、D2受容体遺伝子のエクソン1を含むD2受容体プロモーターによって駆動される遺伝子産物の発現の特異度パーセンテージよりも、5%以上まで、例えば6%以上、7%以上、8%以上、例えば9%以上などまで高い特異度パーセンテージで駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、従来のD2受容体プロモーター、例えば、SEQ ID NO:2(図2)に示される配列と少なくとも90%、例えば、少なくとも95%、少なくとも98%、少なくとも99%または100%同一の配列を有する核酸などの、D2受容体遺伝子のエクソン1を含むD2受容体プロモーターによって駆動される遺伝子産物の発現の特異度パーセンテージよりも、9%以下まで、例えば9.5%以下、9.0%以下、8.5%以下、例えば8%以下などまで高い特異度パーセンテージで駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、従来のD2受容体プロモーター、例えば、SEQ ID NO:2(図2)に示される配列と少なくとも90%、例えば、少なくとも95%、少なくとも98%、少なくとも99%または100%同一の配列を有する核酸などの、D2受容体遺伝子のエクソン1を含むD2受容体プロモーターによって駆動される遺伝子産物の発現の特異度パーセンテージよりも、5〜9%の範囲で、例えば6〜9.5%、6.5〜9.0%、7〜8.5%、例えば7.5〜8.0%の範囲などの高い特異度パーセンテージで駆動する。
場合によっては、D2SPは、これに作動可能に連結された遺伝子産物の発現を、高い浸透度度で駆動する。プロモーターの浸透度は、プロモーターに作動可能に連結された遺伝子産物を発現し、D2受容体に特異的な抗体(例えば、Millipore ab1558;図3)によって陽性染色される細胞の数を、D2受容体に特異的な抗体(例えば、Millipore ab1558;図3)によって陽性染色される細胞の総数で割ったものとして表すことができる。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、70%以上、例えば72%以上、74%以上、76%%以上、78%以上、79%以上、80以上、81%以上、82%以上、83%以上、84%以上、85%以上、86%以上、86.5%以上、86.8%以上、または87%以上の浸透度で駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、99%以下、例えば、95%以下、94%以下、93%以下、92%以下、91%以下、90%以下、89.5%以下、89%以下、89.5%以下、89%以下、88.5%以下、88%以下、87.5%以下、または87%以下の浸透度で駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、70〜95%の範囲の、例えば、75〜95%、例えば、78〜93%、79〜91%、80〜90%、81〜89%、または82〜87%の特異度で駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、約86.8%の浸透度で駆動する。
場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、従来のD2受容体プロモーター、例えば、SEQ ID NO:2に示される配列と少なくとも90%、例えば、少なくとも95%、少なくとも98%、少なくとも99%または100%同一の配列を有する核酸などの、D2受容体遺伝子のエクソン1を含むD2受容体プロモーターによって駆動される遺伝子産物の発現の浸透度パーセンテージよりも、5%以上まで、例えば8%以上、10%以上、12%以上、14%以上、16%以上、17%以上、例えば18%以上などまで高い浸透度パーセンテージで駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、従来のD2受容体プロモーター、例えば、SEQ ID NO:2に示される配列と少なくとも90%、例えば、少なくとも95%、少なくとも98%、少なくとも99%または100%同一の配列を有する核酸などの、D2受容体遺伝子のエクソン1を含むD2受容体プロモーターによって駆動される遺伝子産物の発現の浸透度パーセンテージよりも、35%以下まで、例えば30%以下、25%以下、24%以下、23%以下、22%以下、21%以下、20%以下、19%以下、例えば18%以下などまで高い浸透度パーセンテージで駆動する。場合によっては、D2SPは、それに作動可能に連結された遺伝子産物の発現を、従来のD2受容体プロモーター、例えば、SEQ ID NO:2に示される配列と少なくとも90%、例えば、少なくとも95%、少なくとも98%、少なくとも99%または100%同一の配列を有する核酸などの、D2受容体遺伝子のエクソン1を含むD2受容体プロモーターによって駆動される遺伝子産物の発現の浸透度パーセンテージよりも、5〜35%の範囲まで、例えば8〜30%、10〜25%、12〜20%、14〜19%、例えば16〜18%の範囲などで高い浸透度パーセンテージで駆動する。
ある特定の例において、標的細胞中に導入された核酸中のD2SPに作動可能に連結された遺伝子産物は、上記及び本明細書の他の箇所で記載された光反応性ポリペプチドである。遺伝子産物が、D2SPに作動可能に連結された光反応性ポリペプチドであるとき、標的ニューロンなどの標的細胞中で発現する光反応性ポリペプチドは、このポリペプチドが光によって活性化される場合、標的細胞の過分極または脱分極を誘発させることによって、標的細胞の活性を調節することができる。場合によっては、光反応性ポリペプチドの活性化によって調節される活性は、標的ニューロンにおける活動電位発火のパターンまたは振幅、静止電位、膜電位のおける閾下変化、遺伝子の活性依存的転写及び/または翻訳などである。
いくつかの実施形態において、光活性化ポリペプチドは、細胞(例えば、哺乳動物細胞)の膜上で発現したとき、ならびに活性化波長の光に露光されたときに、膜を過分極する。いくつかの実施形態において、光活性化ポリペプチドは、光電流の長期安定性を示す。いくつかの実施形態において、光活性化ポリペプチドは、細胞膜における発現の向上及び培養ニューロン中のより大きな光電流を示す。いくつかの実施形態において、対象の光活性化ポリペプチドは、減速したチャネル動態/減速したチャネル閉鎖を示す。いくつかの実施形態において、光活性化ポリペプチドは、より低い光強度における簡便な光刺激の後に、アニオンを伝導し、長時間にわたって(例えば、約0.5時間から、最長約0.75時間、最長約1時間、最長約1.25時間、最長約1.5時間、最長約1.75時間、最長約2時間、最長約2.25時間、最長約2.5時間、最長約2.75時間、最長約3時間以上)ニューロン中の活動電位の形成を阻害する。
場合によっては、標的細胞中に導入された核酸中のD2SPに作動可能に連結された遺伝子産物は、上記及び本明細書の他の箇所で記載された蛍光タンパク質ポリペプチドである。遺伝子産物が、D2SPに作動可能に連結された蛍光タンパク質であるとき、標的ニューロンなどの標的細胞中で発現する蛍光タンパク質は、このタンパク質が上述したように、適切な波長の光によって刺激される場合、光を放射することによって標的細胞を蛍光標識することができる。ある特定の実施形態において、蛍光タンパク質は、カルシウムインジケーターまたは電圧インジケーターなどの遺伝的にコードされたインジケーターである。遺伝子産物が、D2SPに作動可能に連結された遺伝的にコードされたインジケーターであるとき、標的ニューロンなどの標的細胞中で発現する遺伝的にコードされたインジケーターは、その蛍光特性、例えば、強度、励起及び/または発光波長などを変更する。
任意の簡便な手段が、D2SPに作動可能に連結された遺伝子産物を発現する標的細胞またはニューロンに送るために用いられてもよく、これによって、標的細胞を調節または蛍光標識する。培養物中または生体外組織片中の標的細胞は、蛍光顕微鏡を用いて光に曝されてもよく、懸濁液中の標的細胞は、蛍光活性化細胞分析分離(FACS)装置または蛍光計などを用いて光に曝されてもよい。
ある場合には、光は、インビボでは、標的細胞またはニューロンに経皮的(transdermally)にまたは皮膚を通して(transcutaneously)送達される。ある場合には、移植可能な光源が使用され、光は体内の部位に送達される。ある場合には、光りは体内の処置部位に送達される。ある場合には、光りは頭蓋内に送達される。
ある場合には、ニューロン内で発現する光反応性ポリペプチドを活性化するために使用される光は、約0.05mW/mm2〜約0.1mW/mm2、約0.1mW/mm2〜約0.2mW/mm2、約0.2mW/mm2〜約0.3mW/mm2、約0.3mW/mm2〜約0.4mW/mm2、約0.4mW/mm2〜約0.5mW/mm2、約0.5mW/mm2〜約0.6mW/mm2、約0.6mW/mm2〜約0.7mW/mm2、約0.7mW/mm2〜約0.8mW/mm2、約0.8mW/mm2〜約0.9mW/mm2、または約0.9mW/mm2〜約1.0mW/mm2の強度を有する。ある場合には、ニューロン内で発現する光反応性ポリペプチドを活性化するために使用される光は、約1.0mW/mm2〜約1.1mW/mm2、約1.1mW/mm2〜約1.2mW/mm2、約1.2mW/mm2〜約1.3mW/mm2、約1.3mW/mm2〜約1.4mW/mm2、約1.4mW/mm2〜約1.5mW/mm2、約1.5mW/mm2〜約1.6mW/mm2、約1.6mW/mm2〜約1.7mW/mm2、約1.7mW/mm2〜約1.8mW/mm2、約1.8mW/mm2〜約1.9mW/mm2、約1.9mW/mm2〜約2.0mW/mm2、約2.0mW/mm2〜約2.5mW/mm2、約2.5mW/mm2〜約3mW/mm2、約3mW/mm2〜約3.5mW/mm2、約3.5mW/mm2〜約4mW/mm2、約4mW/mm2〜約4.5mW/mm2、約4.5mW/mm2〜約5mW/mm2、約5mW/mm2〜約5.5mW/mm2、約5.5mW/mm2〜約6mW/mm2、約6mW/mm2〜約7mW/mm2、または約7mW/mm2〜約10mW/mm2の強度を有する。ある場合には、ニューロン内で発現する光反応性ポリペプチドを活性化するために使用される光は、約0.05mW/mm2〜約0.1mW/mm2の強度を有する。ある場合には、ニューロン内で発現する光反応性ポリペプチドを活性化するために使用される光は、約0.25mW/mm2の強度を有する。ある場合には、光反応性ポリペプチドを活性化するために使用される光は、約1mW/mm2の強度を有する。
有用性
対象の核酸、遺伝子改変宿主細胞及び方法は、インビトロ/エクスビボの遺伝子解析、プロテオーム解析、トランスクリプトーム解析、電気生理学的解析、及び薬理学的解析のために、健康なまたは疾患のあるヒト及び動物対象集団に由来するD2R発現生細胞を、トランスフェクト、同定、標的化、及び単離すること、ならびに健康なまたは疾患のある対象由来の幹細胞/前駆細胞集団からのD2R発現細胞のトランスフェクション、同定、及び単離を含む、多種多様な用途における利用法を見出す。
D2SPを含む核酸は、何十というドーパミン関連障害と関係がある細胞集団の分析及び特性評価のためのみならず、D2R発現細胞の治療用移植の目的のためにも、蛍光活性化細胞分析分離(FACS)などの細胞選別技術を通してのD2R発現細胞の濃縮における利用法を見出すことができる。
いくつかの実施形態において、ドーパミン受容性ニューロンに分化するための細胞の誘導に関与する因子は、D2R発現培養細胞及びD2R発現ヒト由来幹細胞ならびに非ヒト由来幹細胞を研究するためにD2SPを用いて同定され得る。ある特定の実施形態において、薬物依存症、肥満症、ギャンブル依存症などのための移植細胞は、移植用に関連する細胞集団を同定するためにD2SPを用いて、未分化細胞から得ることができる。他の場合には、治療用の新規薬剤は、蛍光タンパク質のD2SPに駆動された発現に基づいて同定された細胞を用いて、ドーパミン受容性ニューロンの分化及び誘導因子に基づいて開発することが可能である。対象の核酸及びそれを用いる方法は、単離及び薬理学的直接刺激もしくは抗体をベースとした介入治療との併用の双方で、患者集団におけるウイルス仲介光遺伝子学構築物の標的化、RNAもしくはDNAを用いた療法、及び他の遺伝子療法アプローチを可能にする。
いくつかの実施形態において、対象の核酸及び方法は、統合失調症、ギャンブル依存症、薬物依存症、トゥレット症候群、多系統萎縮症、核上性麻痺、パーキンソン病、痴呆、自閉症、ADHD、うつ病、遅発性ジスキネジア、神経膠芽腫、強迫的/衝動的性行動、強迫的衝動買い、肥満症、機能性消化不良、胃内容うっ滞、嘔吐、糖尿病性胃アトニー、過敏性腸症候群、クッシング病、高血圧症、及び腎臓炎症/損傷、ならびに女性乳房症、乳汁漏出症、無月経及びインポテンスなどの変質に関連する高プロラクチン血症が挙げられるがこれらに限定されない中枢ならびに末梢障害の両方の研究及び治療のために、遺伝子産物の発現を標的とするために用いることができる。D2R発現細胞はまた、より詳細な特性評価及び薬剤/治療スクリーニングを行うことができるこれらの疾患の動物モデルを提供すると特徴付けることができる。
キット
本開示のさらなる態様は、対象の核酸、すなわち、ドーパミン2型受容体特異的プロモーター(D2SP)を含んでいる核酸を含む、上述した組換え発現ベクターを含むキットを含み、このD2SPは、D2受容体遺伝子のエクソン1を含まず、このD2SPは、コザック配列を含み、またこのD2SPは、SEQ ID NO:1に記載されるヌクレオチド配列と少なくとも95%の配列同一性を有するヌクレオチド配列を含む。ある特定の実施形態において、対象のキットの組換え発現ベクターは、ユーザーが関心対象の遺伝子産物をコードするヌクレオチド配列を組換え発現ベクター中にサブクローニングすることを容易にする複数のクローニングサイト、またはその等価物を含み、これによって、関心対象の遺伝子産物をコードするヌクレオチド配列をD2SPに作動可能に連結する。
ある特定の実施形態において、対象のキットの組換え発現ベクターは、D2SPに作動可能に連結された、光反応性ポリペプチド、遺伝的にコードされたインジケーター及び/または蛍光タンパク質をコードするヌクレオチド配列を含む。
キットはまた、陽性対照発現ベクター及び/または陰性対照発現ベクターなどの対照発現ベクターも含むことができる。いくつかの実施形態において、陽性対照発現ベクターは、D2SPに作動可能に連結された、上述された光反応性ポリペプチドまたは蛍光タンパク質などの、既知の遺伝子産物をコードする核酸を含む。場合によっては、陽性対照発現ベクターは、緑色蛍光タンパク質、黄色蛍光タンパク質、または赤色蛍光タンパク質などの蛍光タンパク質をコードする核酸を含有する。
対象のキットの構成要素は、別個の容器内に入れることができるか、または単一の容器内に組み合わせて入れることができる。
上述した構成要素に加えて、対象のキットは、キットの構成要素を使用して、対象の方法を実行するための説明書をさらに含むことができる。対象の方法を実行するための説明書は、一般的に、適切な記録媒体に記録されている。例えば、説明書は、例えば紙またはプラスチックなどの基材上に印刷されてもよい。このように、説明書は、添付文書として、キットの容器またはその構成要素(すなわち、パッケージまたはサブパッケージに関連する)のラベルなどで、存在してもよい。他の実施形態において、説明書は、好適なコンピュータ可読記憶媒体、例えば、CD−ROM、フロッピーディスク、フラッシュドライブなどとして電子記憶データファイルとして存在する。さらに他の実施形態において、実際の説明書はキット内に存在しないが、例えば、インターネットを介して、リモートソースから説明書を取得するための手段が提供される。この実施形態の例は、説明書を視聴することができ及び/または説明書をダウンロードすることができるウェブアドレスを含むキットである。説明書を視聴することと同様に、説明書を取得するための手段は好適な基材上に記録される。
以下の実施例は、当業者に本発明をどのように行い使用するかの完全な開示及び説明を提供するように提示されており、本発明者らがその発明と見なすものの範囲を限定することを意図するものでもなく、以下の実験が実行される全てまたは唯一のものであることを表明することを意図するものでもない。使用される数値(例えば、量、温度など)に関して精度を確保するための努力がなされているが、ある程度の実験誤差及び偏差を考慮に入れるべきである。特に断りのない限り、部は重量部であり、分子量は重量平均分子量であり、温度は摂氏度であり、圧力は大気圧または大気圧周辺である。標準省略形;例えば、bp、塩基対;kb、キロベース;pl、ピコリットル;sまたはsec、秒;min、分;hまたはhr、時;aa、アミノ酸;kb、キロベース、bp、塩基対;nt、ヌクレオチド;i.m.、筋肉内(筋肉内に);i.p.、腹腔内(腹腔内に);s.c.、皮下(皮下に)などを用いることができる。
実施例1:2型ドーパミン受容体を発現する細胞を抗体染色するためのプロトコール
以下のプロトコールを用いて、固定組織部分内の細胞を2型ドーパミン(D2)受容体特異的抗体で染色した。
A.標準染色プロトコール:
1)40μmの切片をリン酸緩衝生理食塩水(PBS)(pH7.4)中で10分間、3回濯ぐ。
2)PBS+3%正常ロバ血清+0.3%トリトン−X(PBS++)中で30分間ブロッキングする。
3)PBS++中、一次抗体(ウサギ抗D2R、Millipore ab1558)1:500で、ロータリーシェーカー上で4℃にて終夜インキュベートする。
4)薄片をPBS中で15分間、4回洗浄する。
5)PBS++中、二次抗体(Alexa−fluor 647、ヤギ抗ウサギ、Life Technologies A−21245)1:500中で、室温にて3時間インキュベートする。
6)PBS中で15分間洗浄する。
7)PBS中、4’,6−ジアミジノ−2−フェニルインドール(DAPI)1:50000中で15分間洗浄する。
8)PBS中で15分間洗浄する。
上記プロトコールは、図3Aに見られるパターンを生成した。
B.改変染色プロトコール
1)40μmの切片をPBS(pH7.4)中で10分間、3回濯ぐ。
2)PBS+3%正常ロバ血清+0.3%トリトン−X(PBS++)中で30分間ブロッキングする。
3)PBS++中、一次抗体(ウサギ抗D2R、Millipore ab1558)1:200で、ロータリーシェーカー上で室温にて24時間インキュベートする。
4)薄片をPBS中で15分間、4回洗浄する。
5)PBS++中、二次抗体(Alexa−fluor 647、ヤギ抗ウサギ、Life Technologies A−21245)1:500中で、室温にて8時間インキュベートする。
6)PBS中で15分間、4回洗浄する。
7)PBS++中、三次抗体(Alexa−fluor 647、ロバ抗ヤギ、Life Technologies A−21447)1:500中で、室温にて8時間インキュベートする。
8)PBS中で15分間洗浄する。
9)PBS中DAPI 1:50000中で15分間洗浄する。
10)PBS中で15分間洗浄する。
上記プロトコールは、図3Bに見られるパターンを生成した。
実施例2:D2SPはラット海馬一次ニューロンにおいて発現を駆動する
ラット海馬一次ニューロンにD2SP−eNpHR 3.0−EYFPをトランスフェクトし、実施例1に記載された改変染色プロトコールを用いてD2Rに対して染色した(図4)。緑色はEYFPからのものであり、D2SP−eNpHR 3.0−EYFPを発現する細胞を示し、青色は、全てのドーパミン受容体2細胞を示す。
実施例3:D2SP及びD2RのもとでのeNpHR 3.0−EYFPの発現の比較
図5を参照すると、中間パネルは、EYFPを示し、D2SP−eNpHR 3.0−EYFPを発現する細胞(上部)またはD2P−eNpHR 3.0−EYFPを発現する細胞(下部)を示しており、左パネルは、全てのドーパミン受容体2細胞を示す。各プロモーター構築物についての右パネルは、前の2つのパネルの合成を示す。
2つのプロモーターの特異度及び浸透度もまた比較し、表1に示す。
実施例4:D2SPを含有する組換え発現ベクター
1つ以上の遺伝子産物をコードするヌクレオチド配列に作動可能に連結されたD2SPを含有する以下の組換え発現ベクターを構築した:
pAAV−D2SP−hChR2(H134R)−EYFP(図6);
pAAV−D2SP−ehChR2(H134R)−EYFP(図7);
pAAV−D2SP−eNpHR 3.0−EYFP(図8);
pAAV−D2SP−SwiChRca−TS−EYFP(図9);
pAAV−D2SP−EYFP(図10);
pAAV−D2SP−GCaMP 6f(図11);
pAAV−D2SP−GCaMP 6m(図12);
pAAV−D2SP−mCherry−IRES−Cre(図13);及び
pAAV−D2SP−mCherry−IRES−Flpo(図14)。
本発明が、その特定の実施形態を参照して説明されてきたが、当業者であれば、本発明の真の趣旨及び範囲から逸脱することなく様々な変更がなされてもよく、また等価物に置き換えられてもよいことを理解されるべきである。加えて、多くの改変が、特定の状況、材料、物質の組成、プロセス、プロセス工程を本発明の目的、趣旨及び範囲に適合するようになされてもよい。全てのこのような修正は、添付された請求項の範囲内に入るものと意図される。