سمنتيت
|
فيريت (حديد ألفا، حديد دلتا، طري) |
| تصنيفات الفولاذ |
|
فولاذ كربوني (≤2.1% كربون; سبيكة مخففة) |
| مواد حديدية أخرى |
|
حديد الزهر (>2.1% كربون) |
سمنتيت (Cementite) هو طور من الأطوار الموجودة في مخطط الحديد والكربون ويرمز له كيميائيا (Fe3C) حيث يحتوي على 6.67% كربون و93.3% حديد . يتصف بالصلادة العالية BHN 820 ولذلك فهو المسؤول عن مقاومة الصلب العالية للإجهادات. وهو مركب غير مستقر وعند تعرضه إلى درجات حرارة لفترات زمنية طويلة يتحلل مكونا جرافيت وحديد.
الخواص الميكانيكية للسمنتيت
[عدل]- صلد
- شديد القصافة.
- قابليته للمغنطة حتى 210 مئوية.
- له مقاومة للشد ضعيفة
- مقاومته للانضغاط عالية.
وجوده
[عدل]يعرف السمنتيت في علم المعادن باسم «كوهنيت» حيث كان مصدره في الشهب التي تسقط من السماء، وهي سبائك حديد ونيكل وفيها نسبة ضئيلة من الكوبلت ([Fe, Ni, Co]3C) .
ثم عرفناه من تصنيع الحديد والصلب .
تصنيعه
[عدل]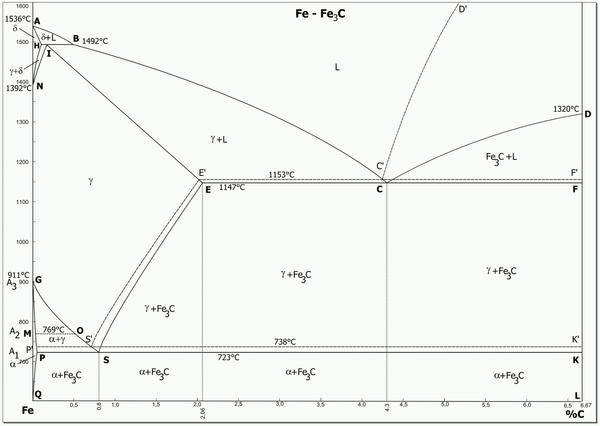
سبائك الحديد حتى نسبة 6و6% كربون؛ الرموز:
> ألفا الحديد = فيريت
>جاما الحديد = أوستنيت
> L (فوق) = حديد منصهر Liquid.

يسمى سمنتيت أولي (Fe3CI) ذلك الذي يتبلور من الحديد المنصهر : متتبعا في ذلك الخط CD في مخطط الحديد والكربون . نسبة الكربون فيه 2.4% - 6.6%.
والسمنتيت الثانوي (Fe3CII) وهو ينتج من ترسيب حديد أوستنيت (جاما)؛ وتتم تلك العملية طبقا للخط ES في مخطط الحديد والكربون . نسبة الكربون 8و0 - 2و4% .
والسمنتيت الثلاثي (Fe3CIII)وهو ذلك الذي يترسب (يتبلور) من الفيريت (ألفا) طبقا للخط PQ. نسبة الكربون فيه أقل من 0.8 %.
تتميز تلك السبائك الحديدية المكونة من الحديد وكربون (بنسبة أقل من 6% كربون) بأنها نظام أصهري ؛ بمعنى أنها في درجات حرارة معينة تسمى نقطة يوتكتيكية ، تكون موجودة في خليط أطوار تسمى بالتالي «مزيج يوتكتويد» يعرف ب ليديبوريت في الحديد الزهر (نسبة كربون 2-6%) ، ويوجد في الفولاذ (برليت ونسبة الكربون فيه أقل من 2%) . عرف خليط لها،
يتكون السمنتيت الأولي ويتبلور في هيئة إبرية. ويترسب السمنتيت الثانوي بسبب قلة ذوبان الكربون في الحديد على جدران الحبيبات المكونة من بلورات أوستنيت ثم بعد ذلك بلورات البرليت. وعند مشاهدته تحت الميكروسكوب يُرى السمنتيت في البرليت في هيئة شرائح سمنتيت. ويترسب السمنتيت الثلاثي على السمنتيت الموجود، في هيئة فيريت نقي على حدود الحبيبات . عن طريق التسخين في درجة حرارة عالية لمدة طويلة يمكن جعل السمنتيت يتخذ أشكالا كرية، مما يحسن من خصائصه.[1]
استخداماته
[عدل]يستخدم كربيد الحديد كمحفز في تفاعلات كيميائية ، مثل تحليل الماء إلى أكسجين وهيدروجين.
المراجع
[عدل]- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعWM
اقرأ أيضا
[عدل]- ^ Jürgen Gobrecht, Erhard Rumpler: Werkstofftechnik - Metalle. Oldenbourg, München 2006, ISBN 3-486-57903-7, S. 139ff.